Требования к оптической системе и фотоприемнику для визуализации живых клеток
Главными аспектами при разработке оптической системы для микроскопических исследований живых клеток являются чувствительность фотоприемника (отношение сигнал/шум), требуемая скорость получения изображений и выживаемость (жизнеспособность) образца. Работая с живыми клетками, необходимо всеми средствами избегать воздействия на них светового излучения сравнительно большой интенсивности и в течение длительных периодов времени, обычно использующихся для получения изображений связанных клеток и тканей (когда основным фактором является фотообесцвечивание). Практически во всех случаях, микроскопия живых клеток представляет собой компромисс между получением изображений наилучшего качества и сохранением жизнеспособности клеток. Скорее, следует, в соответствии с целями исследования, ограничить пространственное и временнóе разрешение, чем без необходимости задавать избыточное количество моментов времени для получения изображений и подвергать клетки чрезмерным уровням освещения.

Рис. 1. Микроскопия живых клеток
Идеальная система регистрации изображений живых клеток должна иметь чувствительность, достаточную для получения высококачественных изображений флуоресцентных образцов с малой интенсивностью излучения, и, в то же время, обладать быстродействием, достаточным для регистрации всех динамических процессов. Кроме того, такая система должна обеспечивать разрешение, необходимое для отображения мельчайших деталей образца, и обладать широким динамическим диапазоном, позволяющим точно измерять самые незначительные различия в интенсивности. К сожалению, оптимизация любого из перечисленных параметров возможна только за счет остальных. Таким образом, на сегодняшний день невозможно создать универсальную систему получения изображений живых клеток, идеально соответствующую всему диапазону возможных исследований. Поэтому, исследователь вынужден идти на компромисс, определяя наиболее важные для оптимизации параметры, одновременно пытаясь ограничить ухудшения, обусловленные теми переменными, которые представляют для него меньший интерес. В конечном счете, конфигурация микроскопа определяется требованиями режима (режимов) получения изображений, необходимостью сохранения жизнеспособности образца в течение всего эксперимента, уровнем сложности протокола мечения клеток и наличием оборудования.
На рисунке 1 представлен современный инвертированный микроскоп исследовательского уровня, предназначенный для изучения тканевых культур. Микроскоп оснащен 4-мя портами для камер, каждый из которых специально предназначен для отдельной камеры, работающей в конкретном режиме съемки (получения изображений). В большинстве случаев, в микроскопах такой конструкции 100 процентов светового потока направляется непосредственно в порт (единовременно в один), либо разделяется, в соотношении 80:20, между одним из портов камеры и окулярами. Для получения важных изображений при низких уровнях освещенности следует устанавливать самые чувствительные камеры в порты, принимающие 100% излучаемого образцом светового потока. Представленная на рисунке 1, цветная ПЗС-камера, подсоединенная к нижнему порту (a), принимающему свет от объектива без отражения от зеркал или призм, используется, в данном случае, для получения изображений мультиокрашенных флуоресцирующих образцов (или окрашенных образцов в режиме светлого поля). Подсоединенная к правому порту высокопроизводительная цифровая камера (b) с электронным умножителем (EMCCD) используется для получения изображений образцов, с очень низкими уровнями флуоресценции. Для получения изображений глубоких слоев толстой ткани в инфракрасном освещении требуется камера (©, левый порт)), оснащенная датчиком с высоким квантовым выходом в спектральном диапазоне 700 — 1000 нанометров. И, наконец, для получения монохромных изображений в режиме полного внутреннего отражения и в других флуоресцентных режимах, идеально подходит камера d (передний порт) с термоэлектрическим охлаждением и сравнительно малым (6 мкм) размером ячеек. Конфигурации, подобные представленной на рисунке 1 дороги, но могут быть в высшей степени адаптивными к основным методам получения изображений.
Для получения изображений живых клеток в оптической микроскопии используются различные методы улучшения контрастности. В большинстве исследований используются те или иные виды флуоресцентной микроскопии, часто в сочетании с одним (или несколькими) методами проходящего света. Понятие флуоресцентной микроскопии охватывает широкопольную эпифлуоресценцию, лазерную конфокальную микроскопию, конфокальную микроскопию с вращающимся диском и разверткой поля, многофотонную микроскопию, микроскопию полного внутреннего отражения (TIRF), флуоресцентную корреляционную спектроскопию, FLIM — микроскопию, фотоактивацию и микроскопию с лазерными ловушками.
Совместно с одним или несколькими основными режимами получения изображений используется спектральная визуализация, формирование цветных изображений, колокализация, последовательная визуализация в заданные интервалы времени, восстановление флуоресценции после фотообесцвечивания (FRAP, FLIP и FLAP), резонансный перенос энергии (FRET), спекл-микроскопия (FSM) и фиксация потенциала. В качестве средств подтверждения локализации флуоресцентного зонда, флуоресцентная визуализация может дополняться традиционными светлопольными методами, включая дифференциально-интерференционный контраст (ДИК), модуляционный контраст Хоффмана (HMC) и фазовый контраст. Практически во всех случаях любая конфигурация микроскопа требует анализа индивидуальных факторов, которые необходимо учитывать для успешного получения изображений живых клеток. Независимо от типов микроскопов и цифровых камер, используемых для визуализации живых клеток, двумя самыми важными и, одновременно, ограничивающими факторами являются обеспечение жизнеспособности клеток и достижение максимально возможного уровня сигнала относительно уровня фоновых помех и автофлуоресценции.
Оптимизация отношения сигнала к шумам при визуализации живых клеток
Одно из фундаментальных различий между визуализацией связанных и живых клеток состоит в том, что в первом случае исследователь имеет достаточную свободу действий в определении таких параметров получения изображений, как местонахождение поля зрения и время экспонирования, а также позволяет настраивать коэффициенты передачи, скорость считывания и значения смещения. В результате, в большинстве случаев (при наличии адекватно окрашенных связанных образцов) можно получать изображения с использованием полного динамического диапазона камеры, получая оптимальные отношения сигнал/шум. К сожалению, с живыми клетками ситуация иная, и это связано с ограничениями, накладываемыми на параметры визуализации строгим требованием сохранения жизнеспособности клеток. Очень часто, при визуализации живых клеток интенсивность образца только на несколько градаций серого цвета выше интенсивности фона. В этом случае, наиболее важными факторами визуализации становятся уровни темнового тока и шумов считывания фотоприемника. Дешевые камеры, как правило, характеризуются довольно высокими уровнями шумов, что ведет к менее равномерному изображению фона, часто перекрывающему сигнал от образца. При повышении скорости считывания этот эффект усиливается. Практически во всех случаях визуализации живых клеток успех или неудача эксперимента определяется выбором фотоприемника.
Основными четырьмя источниками помех в цифровых системах визуализации являются фотоприемник, осветительная система, пуассоновский или дробовой шум (обусловленный стохастическим характером потока фотонов) и рассеянный свет. В большинстве случаев, систематического снижения помех можно добиться тщательным выбором фотоприемника и оптимизацией режима освещения. Детекторы фотонов (фотоприемников) практически всех типов создают некоторый уровень помех (шумов) в каждом измерении, регистрируемом устройством. Использующиеся в лазерной сканирующей и многофотонной микроскопии фотоумножители могут генерировать паразитные электроны в системе усиления сигнала. Аналогично, приборы с зарядовой связью (ПЗС), использующиеся в широкопольной, деконволюционной микроскопии, в микроскопии полного внутреннего отражения, а также в микроскопии с вращающимися дисками и разверткой поля, формируют темновой ток, связанный с каждой ячейкой. Совершенствование конструкций ПЗС и фотоумножителей, включая охлаждение эти устройств до очень низких температур, уменьшает вклад темнового тока в общий уровень шумов до очень низких значений. Однако, ПЗС, особенно это касается устройств со считыванием каждой ячейки и преобразованием аналогового сигнала в цифровой эквивалент, создают дополнительную шумовую составляющую, известную под названием шумов считывания, и представляющую собой основной источник шумовых искажений в охлаждаемых цифровых камерах нынешнего поколения.

Рис. 2. Влияние чувствительности и скорости считывания цифровых камер на качество
На рисунке 2 представлена взаимозависимость чувствительности, скорости считывания цифровой камеры и качества изображения при визуализации живых клеток. В качестве образца использовалась культура клеток цервикальной карциномы человека (линия HeLa), экспрессирующих слияние мономерного флуоресцентного белка Kusabira Orange (mKO) и alpha-тубулина человека. Изображение получено при широкопольном люминесцентном освещении с комбинацией фильтра TRITC и полутоновой камеры, со скоростями считывания 10 или 1,25 МГц. Когда ПЗС-матрица камеры закрыта (не принимает свет), фоновые шумы (помехи) значительно ниже в режиме малой скорости считывания, что видно из рисунков 2(a) и 2(b), на которых представлены изображения, полученные на скоростях, соответственно, 10 и 1,25 МГц. В том случае, когда можно задать время экспонирования, позволяющее использовать весь динамический диапазон камеры, это различие не оказывает серьезного влияния на ее характеристики, что подтверждается одинаковым качеством изображений, представленных на рисунках 2© и 2(d). Однако, в условиях низкой освещенности, меньшая скорость считывания (рисунок 2(f)) дает более высокое качество. Представленные на рисунках 2(e) и 2(f) изображения были получены при интенсивности освещения, приблизительно, в 10 раз меньшей, чем изображения, показанные на рисунках 2© и 2(d). Снижение уровня освещенности еще в 5 раз дает значительно больший эффект (см. рисунки 2(g) и 2(h)). В этом случае качество изображения, полученного на низкой скорости считывания, находится на грани допустимого (рисунок 2(h)), тогда как в режиме быстрого считывания (рисунок 2(g)) качество изображения недопустимо низкое.
Для успешного выполнения эксперимента по цифровой визуализации пространственное распределение освещенности образца должно быть постоянным по всему полю зрения и для всей последовательности изображений. Как правило, оптические характеристики микроскопов с вольфрамовыми-галогенными лампами достаточно постоянны по всему полю образца (пространственная инвариантность). Однако, в лазерных сканирующих микроскопах доза светового излучения, попадающего на отдельный пиксель, при каждом сканировании может быть разной. Кроме того, использующиеся в широкопольной флуоресцентной микроскопии источники с ртутными плазменно-дуговыми лампами не обеспечивают равномерную интенсивность по всему спектру, а характеризуются дискретными пиками высокой интенсивности на конкретных длинах волн. Ксеноновые лампы, напротив, дают намного более равномерный профиль распределения интенсивности в пределах видимого спектра, но недостаточно интенсивны в его ультрафиолетовой области (диапазон освещения, которого, обычно, избегают при визуализации живых клеток).
Наилучшим вариантом является комбинированная дуговая лампа, (например, металлогалоидная), обладающая, вероятно, наилучшими характеристиками ртутной и ксеноновой ламп, с непрерывным спектром от ультрафиолетовой до инфракрасной областей, в дополнение к интенсивным линиям ртути. Почти равномерное поле освещения можно получить независимо от источника света, поместив между блоком осветителя и входным осветительным портом оптической системы микроскопа волоконный (или жидкий) световод. Все остаточные градиенты освещенности поля зрения можно скорректировать путем вычислений по алгоритмам «равномерного поля». Важно отметить, что колебания выходной мощности лампы, которые могут достигать 10% от среднего значения, не корректируются оптоволокном и требуют использования стабилизированного источника питания.
По своей природе, измерение фотонного потока — процесс статистический, характеризующийся фактором неопределенности, связанной с обнаружением сигнала. Результирующий эффект (уже упоминавшийся пуассоновский или дробовой шум) состоит в том, что при измерении N фотонов неопределенность равна квадратному корню из N, являясь, одновременно, отношением «сигнал/шум». Увеличение числа сигнальных фотонов (N) напрямую ведет к улучшению отношения «сигнал/шум» и контрастности изображения. Простейший способ улучшения отношения «сигнал/шум» состоит в регистрации большего количества фотонов, обычно, за счет удлинения экспозиции или увеличения уровня возбуждающего излучения, однако, эти меры увеличивают фототоксичность и снижают жизнеспособность клеток. Альтернативный и, возможно, более подходящий метод состоит в повышении чувствительности фотоприемника.
Для преодоления проблемы низких уровней яркости, свойственных процессу визуализации живых клеток, чувствительность современных цифровых ПЗС-камер можно существенно повышать за счет метода, известного под названием бининг (рис. 3 и 8). В процессе обычного считывания содержимое одного горизонтального ряда ячеек ПЗС-матрицы (пикселей) преобразуется, помещается в регистр чтения и, затем, анализируется. В результате бининга сигналы (фотоэлектроны) группы соседних ячеек (например, блока 2×2 или 4×4) формирователя изображения объединяются, и в матрице (массиве данных) считывания рассматриваются, как сигнал одной ячейки. Бининг реализуется путем записи сигналов нескольких параллельных рядов ячеек в последовательный регистр чтения (например, двух рядов — для бининга 2×2 и четырех — для бининга 4×4), с последующим одновременным считыванием групп из 2, 3 или более ячеек. Бининг формата 2×2 дает двукратное ухудшение разрешения, четырехкратное увеличение уровня сигнала и двукратное улучшение отношения «сигнал/шум». Очевидно, что в приложениях с ограниченным уровнем сигнала улучшение будет значительным, но достигнутым за счет ухудшения пространственного разрешения.

Рис. 3. Влияние бининга на пространственное разрешение и окончательные размеры изображения
Рисунок 3 иллюстрирует влияние объединения соседних ячеек на пространственное разрешение и окончательные размеры цифровых изображений, полученных путем повышения уровня бининга. Образцом является культура клеток фибробласта кожи индийского оленя-мунтжака, экспрессирующих слияние флуоресцентного (псевдоокрашенного красного) белка mCherry и beta-актина человека, с локализацией в стрессорных волокнах, включающих в себя филаментозную цитоскелетную сеть. Как это обычно наблюдается с флуоресцентными белковыми метками, часто наилучшую локализацию демонстрируют клетки с очень низкими уровнями экспрессии продукта слияния, что существенно снижает уровень формируемого сигнала. В отсутствие бининга (рисунок 3(a)) сигнал настолько слаб, что при временах экспонирования, обеспечивающих незначительные уровни фототоксичности и фотообесцвечивания, его невозможно выделить. Бининг 2×2 и 4×4 последовательно повышает уровень сигнала, но за счет ухудшения пространственного разрешения (рисунки 3(b) и 3©). Самое яркое изображение, полученное с бинингом 8×8 ячеек (рисунок 3(d)), страдает сильным ухудшением разрешения. Важно отметить, что с увеличением числа ячеек, объединяемых в процессе бининга, пропорционально уменьшаются размеры изображения. Например, не подвергнутое бинингу (1×1) исходное изображение на рисунке 3 состоит из 1360×1024 пикселей, тогда как изображения с использованием бининга (2×2), (4×4) и (8×8) имеют размеры 680×512, 340×256 и 170×128 пикселей. В иллюстративных целях, размеры этих изображений на рисунке также соответствующим образом уменьшены. Аналогично, с использованием подобной схемы бининга, цифровая камера с дисплеем 512×512 будет формировать изображения с размерами 256×256, 128×128 и 64×64 пикселей.
Ключевой аспект концепции бининга состоит в том, что шумы чтения образуются после объединения ячеек, и к результирующему пикселю, состоящему из сигналов нескольких объединенных ячеек, добавляются только один раз. И, напротив, если среднее значение сигнала от блока 2×2 ячеек вычисляется после сбора данных, результат будет хуже, вследствие отдельного вклада шумовой составляющей каждой из четырех ячеек. Итак, несмотря на то, что бининг ухудшает пространственное разрешение, он позволяет существенно улучшить отношение «сигнал/шум», что особенно важно в экспериментах с фоточувствительными клетками, где требуются низкие уровни освещенности и малые времена экспонирования. Критическим параметром визуализации живых клеток часто является способность обнаруживать, а не пространственно разделять слабые флуоресцентные сигналы. Поэтому, повышение интенсивности изображения и скорости его формирования за счет бининга с лихвой компенсируют ухудшение разрешения. В качестве альтернативы бинингу, многие высококлассные камеры позволяют сокращать время формирования изображения за счет считывания сигналов только с некоторой избранной области ячеек ПЗС-матрицы. Этот метод позволяет сократить время воздействия на клетки вредного для них освещения, не ухудшая пространственное разрешение.
С целью устранения недостатков традиционных высококлассных ПЗС-камер в сфере приложений, требующих высокой частоты смены кадров при чрезвычайно низких уровнях освещенности, их изготовители предложили инновационный метод усиления слабых сигналов выше уровня собственных шумов чтения ПЗС-матрицы. За счет размещения (на уже имеющемся полупроводниковом кристалле) регистра-умножителя, устройства с электронными умножителями (EMCCD), при значительно меньшей стоимости, а также без ухудшения квантового выхода и разрешения стандартной ПЗС-архитектуры, достигают чувствительности, позволяющей обнаруживать единичные фотоны, — типичной для ПЗС-устройств с электронно-оптическим преобразователем или с бомбардировкой (управлением) электронным пучком. Отличительным свойством EMCCD-устройств является размещение на кристалле фотоприемника специального расширенного последовательного регистра, который формирует коэффициент умножения за счет ударной ионизации внутри кремниевой структуры (см. рисунок 4). Формируемый фотонами заряд поднимается выше уровня шумов чтения даже на высоких скоростях смены кадров, и пригоден для любых современных ПЗС-датчиков, включая устройства с задней подсветкой.

Рис. 4. ПЗС-архитектура со сдвоенным усилителем и электронным умножителем
Благодаря тому, что каскад усиления сигнала в камере EMCCD-типа встроен непосредственно в структуру ПЗС-матрицы, такие камеры значительно дешевле в изготовлении, чем ПЗС-камеры с электронно-оптическим преобразователем. Для критических исследований живых клеток с сигналами низкой интенсивности, каковые свойственны методам визуализации единичных молекул, полного внутреннего отражения, микроскопии с вращающимися дисками и разверткой поля, определению потока ионов кальция или других элементов, а также трехмерной микроскопии с временным разрешением, метод EMCCD дает значительные преимущества в сравнении с другими датчиками, предназначенными для низких уровней сигнала. Кроме того, при работе с бóльшими уровнями сигналов, имеющими место в традиционных методах флуоресцентной визуализации, чрезвычайная чувствительность EMCCD-cистем дает возможность использовать меньшие концентрации флуорофоров и/или источники возбуждения более низкой мощности, снижая, тем самым, фототоксичность и фотообесцвечивание флуоресцентного зонда.
Оптическая система микроскопа
Микроскопы, предназначенные для визуализации живых клеток, должны иметь высококачественный штатив, изготовленный из прочных композитных материалов или из алюминия, прочно крепящийся на защищенную от вибраций платформу. Внешние оптические поверхности, а также корпуса элементов (конденсора, блока осветителя, револьвера с объективами и др.) необходимо содержать в чистоте, а окружающая микроскоп среда должна иметь низкий уровень относительной влажности и не содержать частиц пыли. Наряду с со стандартными процедурами, которые необходимо выполнять при визуализации живых клеток, необходимо, также, обеспечивать юстировку оптического пути и диафрагм для освещения по Келеру. Если лабораторное помещение, в котором установлен микроскоп, позволяет перекрыть все верхнее освещение, то оно обеспечивает исследователю значительные преимущества в виде снижения уровня рассеянного света, проникающего в микроскоп через окуляры или камеру для образцов.
Цифровые электронные камеры устанавливаются, как правило, в специальные порты на корпусе микроскопа, при помощи специальных адаптеров. Микроскопы научно-исследовательского уровня часто оснащаются несколькими портами, что позволяет подсоединять к ним несколько камер одновременно (см. рисунок 1). Это особенно удобно в случае использования микроскопа в различных режимах визуализации, поскольку позволяет, в случае необходимости, быстро получить доступ к камере, оптимально настроенной на нужный метод улучшения контрастности. Внутри корпуса микроскопа устанавливается ряд определенным образом расположенных и ориентированных зеркал, светоделителей и призм, с помощью которых формирующие изображение образца световые волны направляются в различные порты для камер и в окуляры. Важно отметить, что весь световой поток, направляемый во время получения изображений в окуляры микроскопа, формируется в ущерб потоку, направляемому в камеру, что ухудшает отношение «сигнал/шум». Поэтому, при визуализации флуоресцентных образцов с ограниченным фотонным потоком, микроскопы такой конструкции должны быть настроены таким образом, чтобы в порт соответствующей камеры направлялись 100% светового потока.
Важнейшую роль в получении и передаче в оптическую систему микроскопа максимального сигнала от образца играет объектив. Чрезмерное количество элементов, например, зеркал, светоделителей, проекционных линз, фильтров и призм на оптическом пути света может существенно ухудшить отношение «сигнал/шум» получаемых изображений, вследствие чего это количество должно быть сведено к абсолютному минимуму. Чтобы собрать максимальное количество света, поступающего от флуоресцентного образца, требуются объективы с высокой числовой апертурой. Числовая апертура, определяющая количество света от одиночного точечного источника, которое может собрать линза (объектив), является, вероятно, самым важным критерием выбора объектива для визуализации живых клеток.
Значение числовой апертуры выгравировано на тубусе (корпусе) объектива и находится в диапазоне от 0,25 для сухих объективов с малым увеличением (10x) до 1,20 для водо-иммерсионных и до 1,45 для масляно-иммерсионных объективов (с увеличением от 40x до 100x). Математически числовая апертура определяется следующим выражением: числовая апертура (NA) = показатель преломления (γ) • угол зрения объектива (sin(β))
Таким образом, способность объектива собирать лучи определяется показателем преломления (γ) среды, находящейся между его передней линзой и образцом, умноженным на синус угла (β) максимально дифрагированных (отклонившихся) лучей света, способных участвовать в формировании изображения. Более того, разрешение формируемого объективом изображения также является функцией числовой апертуры. Согласно критерию Релея (консервативная оценка) разрешение равно константе (0,61), умноженной на длину волны освещения и деленной на числовую апертуру объектива. Кроме того, числовая апертура определяет интенсивность (яркость) изображения, которая пропорциональна четвертой степени числовой апертуры и обратно пропорциональна квадрату увеличения.
Таким образом, небольшое увеличение числовой апертуры может дать значительное увеличение уровня сигнала. По этой причине, для флуоресцентной визуализации живых клеток требуются, как правило, объективы с максимальной числовой апертурой, в сочетании с иммерсионной средой (масло или вода), обладающей высоким показателем преломления.
Как уже упоминалось, яркость обратно пропорциональна квадрату коэффициента увеличения объектива, поэтому, зачастую, для визуализации тусклых образцов предпочтительны объективы с малыми коэффициентами увеличения. Например, если при визуализации образца при помощи объектива с увеличением 100x и числовой апертурой 1,4 ограничивающим фактором становится отношение «сигнал/шум», то переход к объективу с увеличением 60x или 40x и аналогичной числовой апертурой существенно увеличит яркость изображения. В действительности, отдельный элемент изображения в свете флуоресценции, полученный через объектив с увеличением 60x, будет выглядеть почти в три раза ярче, чем через объектив с увеличением 100x (числовая апертура обоих объективов равна 1,4). Измеренная (наблюдаемая) интенсивность зависит и от качества передачи света объективом, поэтому, для достижения конечного увеличения, требуемого конкретным экспериментом, всегда целесообразно рассмотреть совместное использование увеличения и бининга.
Для получения изображений мультиокрашенных связанных (а в некоторых случаях, и живых) клеток идеальными считаются объективы с хорошей коррекцией хроматической аберрации во всем видимом спектре (от 400 нм до 700 нм, т. н. апохроматы), и с равномерной плоскостью изображения (т. н. план или плано). К сожалению, апохроматические и планапохроматические объективы, как и объективы с расширенным полем зрения, неизбежно состоят из большего количества оптических элементов (линз), чем менее точные объективы (ахроматы и флюориты). Высокая степень коррекции позволяет с минимальными искажениями использовать эти объективы для микроскопии в проходящем свете, включая фазовый и дифференциально-интерференционный контраст. Однако, в результате, светопропускание приносится в жертву оптимальной оптической коррекции, — обстоятельство, оказывающее незначительное влияние на визуализацию связанных клеток, но, зачастую, оказывающееся контрпродуктивным при формировании изображений живых клеток. Эту оборотную сторону медали лучше всего демонстрирует тот факт, что планапохроматический объектив с ккратностью увеличения 40x и числовой апертурой 1,4, который теоретически должен обеспечивать в шесть раз большую яркость, чем аналогичный объектив с увеличением 100x, на практике дает только четырехкратное увеличение яркости. Несмотря на это, объективы с увеличением 40x и 60x обеспечивают, все же, самые яркие изображения, достижимые на предельных значениях оптического разрешения.

Рис. 5. Влияние числовой апертуры объектива на получение флуоресцентных изображений
На рисунке 5 представлен пример принципиальной важности числовой апертуры в отношении разрешения и яркости изображения. Образец представляет собой культуру адгезивных клеток почечного эпителия африканской зеленой мартышки (линия CV-1), трансфецированных вектором плазмиды, кодирующим усовершенствованный зеленый флуоресцентный белок, слитый с митохондриальной нуклеотидной последовательностью-мишенью из субъединицы VIII человеческой цитохром-с-оксидазы. После транскрипции и трансляции плазмиды в трансфецированных клетках-хозяевах млекопитающих, за транспортировку и распределение химер флуоресцентного белка по клеточной митохондриальной сети отвечает сигнал митохондриальной локализации. Впоследствии трубчатые митохондрии можно визуализировать при помощи флуоресцентной микроскопии.
На рисунке 5 представлено одно и то же поле зрения, полученное при помощи объективов с одинаковыми уровнями оптической коррекции (планфлюоритовые объективы) и значениями числовой апертуры (1,3), но в диапазоне увеличений от 40x до 100x. Хотя число ячеек и режимы фотоприемника, использовавшиеся для получения представленных на рисунке 5 изображений, были идентичными, ярче всего митохондрии выглядят на изображении, полученном через объектив с увеличением 40x (рисунок 5(a); все изображения были приведены к одному размеру). И, напротив, объективы с бóльшим увеличением — 60x и 100x (рисунки 5(b) и 5©, соответственно) дают изображения постепенно уменьшающейся яркости, причем, изображение, полученное через объектив с увеличением 100x, почти неразличимо. Тем не менее, этот объектив можно использовать для визуализации рассматриваемого образца, но для этого необходимо существенно увеличить коэффициент усиления фотоприемника, получив, в результате, ухудшение отношения «сигнал/шум» и общего качества изображения. Отметим, что значения разрешающей способности представленных объективов (рисунки 5(d) — 5(f)) сравнимы, в силу одинакового значения числовой апертуры.
Одно из концептуальных положений, вытекающих из данных рисунка 5, состоит в необходимости избегать использования объективов с чрезмерно большим увеличением для визуализации флуоресцентных белков (и флуорофоров, вообще). В результате простого цифрового увеличения (зуммирования) в процессе формирования изображения при помощи конфокального микроскопа с объективом 40x или 60x, получается изображение, по размеру эквивалентное полученному через объектив с увеличением 100x (рисунки 5(d) и 5(e)). Разрешающие способности обоих объективов одинаковы, поскольку одинаковы их числовые апертуры. Аргумент касательно относительной несущественности коэффициента увеличения не следует трактовать в пользу нецелесообразности использования объективов с увеличением 60x или 100x. В действительность, объектив с большим коэффициентом увеличения зачастую необходим, в частности, для визуализации очень мелких объектов, например, пероксисом или секреторных гранул, при помощи широкопольного микроскопа.
Поскольку размер изображения относительно размера фотоприемника играет важную роль в определении частоты пространственной дискретизации, оптимальный коэффициент увеличения определяется параметрами цифровой камеры (размером элемента изображения ПЗС и промежуточным коэффициентом увеличения). Таким образом, выбор наилучшего объектива зависит, как правило, от оптической конфигурации аппаратуры и индивидуальных требований конкретного эксперимента.
В тех случаях, когда отношение «сигнал/шум» важнее разрешения, часто лучшим выбором являются объективы с меньшей степенью коррекции (с меньшим количеством оптических элементов), обладающие значительно бóльшим светопропусканием. Кроме того, следует проявлять осторожность, выполняя съемку через объективы, содержащие оптические элементы, которые существенно снижают прохождение света, например, уменьшающие амплитуду пластины в фазово-контрастных объективах. Это редко становится проблемой при визуализации в проходящем свете, но может существенно снизить уровень сигнала (на 15 — 20%) во флуоресцентном режиме съемки. По этой причине не следует использовать фазовые объективы для визуализации живых клеток с малораспространенными зондами, если только протокол эксперимента не требует наложения фазово-контрастных и флуоресцентных изображений. Аналогично, при получении комбинированных изображений с использованием флуоресценции и ДИК, перед съемкой флуоресцентных изображений необходимо убрать из оптической системы анализатор поляризованного света (уменьшает амплитуду сигнала, приблизительно, на 30%), который, обычно, размещается на общем оптическом пути, непосредственно под объективом.
Любые дефекты, присутствующие в оптической системе микроскопа влияют на отношение «сигнал/шум» получаемого изображения. Наиболее распространенным искажением при визуализации живых клеток через объективы с высокой числовой апертурой является сферическая аберрация, которую необходимо устранять. Это искажение обусловлено несовпадением показателей преломления среды, в которой находятся клетки (обычно, это водный раствор с показателем преломления 1,33), и иммерсионной среды объектива.
Обычно, сферическая аберрация проявляется в виде неравномерного удлинения вдоль оптической оси, в результате чего рассматриваемое изображение оказывается сильно вытянутым и искаженным. Поскольку при наличии аберрации сигнал распространяется по значительно большему объему, отношение «сигнал/шум» уменьшается. Эта проблема намного более серьезна при визуализации глубоких слоев толстых тканей, чем адгезивных клеток на покровном стекле (толщиной, как правило, всего лишь несколько микрометров). Решение, в большинстве случаев, состоит в использовании водо-иммерсионного объектива, показатель преломления иммерсионной среды которого намного более близок к показателю преломления культуральной среды. В качестве альтернативного решения можно соответствующим образом изменить показатель преломления иммерсионной среды или толщину покровного стекла. Важно помнить, что показатель преломления зависит от температуры, поэтому, оптимальные комбинации иммерсионной среды и толщины покровного стекла для комнатной температуры и для 37 градусов Цельсия, различны. Для компенсации флуктуаций показателей преломления, вызываемые изменениями температуры, можно использовать новейшие иммерсионные объективы с коррекционными кольцами.
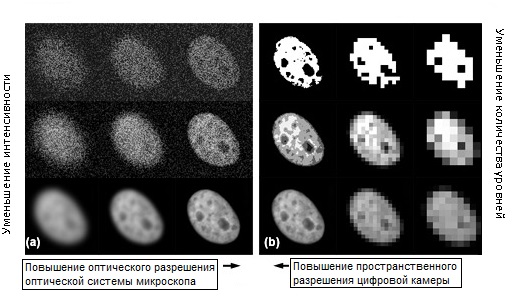
Рис. 6. Ограничения оптической системы микроскопа и фотоприемника цифровой камеры
Рисунок 6 иллюстрирует существенные ограничения оптической системы микроскопа (панель (a)) и фотоприемника цифровой камеры (панель (b)) при визуализации живых клеток. Образец состоит из одиночного интерфазного ядра адгезивной клетки почечного эпителия кенгуровой крысы (линия PtK2), экспрессирующей усовершенствованный зеленый флуоресцентный белок (EGFP), слитый с локализованной в ядре гистоновой последовательностью H2B. Изображение получено в режиме широкопольной флуоресценции с эпископическим освещением. Изображения с наилучшей разрешающей способностью оптической системы представлены в нижнем правом углу панели (a), а с наилучшим оптическим разрешением цифровой камеры — в нижнем левом углу панели (b). В микроскопии живых клеток оптическая система определяет количество света, имеющегося для формирования контраста, а также физический предел разрешающей способности, который задается числовой апертурой объектива и длиной волны освещения. С увеличением интенсивности освещения (при перемещении сверху вниз по панели (a)), шумы регистрации фотонов становятся менее заметными, а качество изображения резко повышается. Аналогично, с повышением оптического разрешения (слева направо на панели (a)), становятся заметнее более мелкие детали ядра.
Цифровая камера считывает оптическую информацию из микроскопа и выбирает данные соответственно дискретным уровням освещенности и элементам пространственного разрешения (рисунок 6, панель (b)). С увеличением размера ячейки (слева направо по панели (b)), исчезают многие мелкие детали, пока изображение не становится «блочным» и почти неразличимым (нижний правый угол на панели (b)). С уменьшением количества уровней яркости, использующихся для считывания и отображения изображения (снизу вверх по панели (b)), уменьшается градация тонов, оставляя только детали с очень высокой контрастностью (верхний горизонтальный ряд на панели (b)). Следует отметить, что в процессе формирования данных эти два фактора работают совместно. Итак, в экспериментах по визуализации живых клеток количество собираемой информации должно быть пропорционально требованиям к исследованию.
В микроскопии живых клеток используются различные специальные фильтры и зеркала, предназначенные для задания направления и точной настройки волнового спектра испускаемого света и света, освещающего образец на всем пути прохождения от источника света через микроскоп (и образец) к фотоприемнику. В режиме проходящего света оптической системой улучшенного контраста, элементами, модифицирующими излучение, являются поляризаторы и призмы (ДИК) или диафрагмы конденсора и фазовые кольца (фазовый контраст и модуляционный контраст Хоффмана). Поскольку суммарный световой поток через оптическую систему микроскопа при визуализации в режимах светлого поля, ДИК и фазового контраста намного выше, чем в режиме флуоресценции, для повышения отношения «сигнал/шум» в трех первых режимах требуются, как правило, очень небольшие усовершенствования. Прежде всего, необходимо отфильтровать из спектра вольфрамово-галогенной лампы осветителя фототоксичные ультрафиолетовую и инфракрасную составляющие, чтобы не допустить их воздействия на образец. Блокирование инфракрасного излучения необходимо для предотвращения теплового повреждения клеток и уменьшения уровня фоновой засветки, осложняющей выделение сигнала из шумов при использовании чувствительных к ИК-излучению камер. Ультрафиолетовая составляющая ламп проходящего света создает меньше проблем, тем более, что ее воздействие на образец можно легко контролировать при помощи зеленого или красного интерференционного фильтра. Фильтры, как инфракрасного, так и видимого излучения существенно снижают уровни освещенности, в связи с чем, для сохранения требуемого отношения «сигнал/шум», может возникнуть необходимость в увеличении экспозиции и коэффициента передачи фотоприемника.
Для правильного выбора соответствующих диапазонов длин волн возбуждающего светового излучения, а также для сбора излучения от флуоресцирующих меток образца, в режиме флуоресцентной визуализации используются комбинации интерференционных фильтров и дихроичных зеркал. Довольно низкие, в сравнении с режимами проходящего света, уровни яркости во флуоресцентной микроскопии делают выбор фильтров критичным фактором в достижении адекватных отношений «сигнал/шум». В большинстве случаев, в частности, когда предметом интереса является проступание сигнала, обусловленное наложением профилей эмиссии флуорофоров, необходимо использовать полосовые фильтры для возбуждающего и испускаемого излучений (барьерные фильтры). Часто, присущие таким фильтрам узкие спектральные окна, дополнительно ограничивают количество проходящего через микроскоп света, и вынуждают исследователя искать оптимальную полосу пропускания для получения удовлетворительных изображений.
Производители микроскопов и других оптических компонентов предлагают широкий спектр специальных комбинаций полосовых фильтров и дихроичных зеркал. С целью получения оптимального отношения «сигнал/шум» комбинация фильтров для визуализации живых клеток должна очень точно соответствовать спектральному профилю использующихся в эксперименте флуорофоров. Например, использование стандартного комплекта флуоресцеиновых фильтров (FITC), предназначенных для применения с методом многоцветного окрашивания при визуализации клеток, экспрессирующих исключительно желтый флуоресцентный белок (YFP), будет без необходимости ослаблять флуоресцентный YFP-поток, который, в противном случае, мог бы улучшить отношение «сигнал/шум» (см. рисунок 7(a)). Значительно лучший результат (более интенсивный сигнал) в этом случае даст, согласованное с профилями поглощения и испускания флуорофора YFP, сочетание полосового фильтра для возбуждающего излучения и длинноволнового порогового фильтра — для испускаемого излучения.
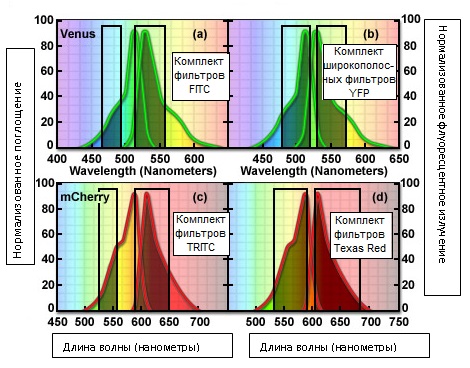
Рис. 7. Оптимизация флуоресцентного сигнала при помощи комбинации светофильтров
На рисунке 7 представлен пример оптимизации комбинаций флуоресцентных фильтров, с целью получения максимально возможного уровня сигнала для двух производных популярного флуоресцентного белка. Верхняя панель (рисунки 7(a) и 7(b)) иллюстрирует суперпозицию спектров поглощения и излучения Venus — продукта сайт-направленного мутагенеза желтого флуоресцентного белка YFP, и комплекта фильтров FITC (рисунок 7(a)), а также специальной широкополосной комбинации, предназначенной для достижения максимального уровня сигнала, получаемого, в общем случае, от желтых флуоресцентных белков (рисунок 7(b)). Хотя, в отношении уровня сигнала, проходящего к фотоприемнику, фильтры испускания аналогичны, совпадение (наложение) спектра поглощения Venus и полосы пропускания фильтра возбуждения (FITC) значительно меньше, чем это имеет место с широкополосным комплектом YFP, что ведет к недостаточному уровню возбуждения и ослаблению сигнала. Аналогично, комбинированный фильтр TRITC (рисунок 7©) возбуждает флуоресцентный белок mCherry не так эффективно, как комплект фильтров Texas Red (рисунок 7(d)). Кроме того, более широкая полоса пропускания фильтров комбинации Texas Red лучше пропускает сигнал к фотоприемнику. Для обеспечения максимальной эффективности возбуждения и испускания, необходимо тщательно исследовать каждый использующийся для визуализации живых клеток флуоресцентный белок в отношении выбранной комбинации фильтров.
Вдобавок к стандартным комбинациям фильтров, предназначенным для визуализации отдельных флуорофоров, в настоящее время выпускаются многополосные наборы, позволяющие одновременно освещать и регистрировать образцы, окрашенные двумя и более флуоресцентными зондами. Дополнительным фактором, который необходимо учитывать при точной настройке оптической системы микроскопа, является принципиальное местоположение нейтральных светофильтров, предназначенных для снижения уровней возбуждающего излучения (что критично для визуализации живых клеток в свете флуоресценции), а также ультрафиолетовых и инфракрасных фильтров, использующихся для снижения или устранения фототоксичности образца. Обычно, эти фильтры устанавливаются между дуговым (или лазерным) источником освещения и входным осветительным портом микроскопа, и могут легко заменяться, с целью оптимизации светопропускания. Тщательная настройка апертурной и полевой диафрагмы конденсора или эпископического осветителя, также позволяет отрегулировать интенсивность и числовую апертуру проходящего через микроскоп света.
Согласование оптического разрешения с геометрией фотоприемника
При условии, что оптическое изображение адекватно дискретизируется фотоприемной системой, пространственное разрешение формирующегося в микроскопе изображения определяется, как правило, разрешающей способностью оптической системы. Поскольку ПЗС-фотоприемник представляет собой матрицу фотодиодов, каждый из которых имеет фиксированный размер, разрешение изображения может ограничиваться геометрией отдельных пикселей. Для достижения полной разрешающей способности микроскопа, размер фотоприемника должен удовлетворять критерию дискретизации Найквиста — от 2,5 до 3 пикселей для каждой единицы диска Эйри. Например, в случае предельного оптического разрешения в 250 нанометров, размер пикселя результирующего изображения должен равняться, приблизительно, 80 — 100 нанометров. В сфере визуализации живых клеток, где отношение «сигнал/шум», зачастую, важнее оптического разрешения, для формирования изображений без видимого ухудшения качества наиболее целесообразно ограничиться 2-я пикселями на один диск Эйри. Уменьшение количества пикселей на единицу диска Эйри повышает яркость изображения и позволяет использовать ПЗС-фотодиоды большего размера, которые аккумулируют большее количество фотоэлектронов.
На рисунке 8(a) представлены проекции изображений дисков Эйри на поверхность матрицы ПЗС-ячеек через объективы с высокими числовыми апертурами, которые, обычно, используются для визуализации живых клеток. Размер каждой ячейки матрицы равен 6-и микронам. Объектив с увеличением 100x и числовой апертурой 1,4 проецирует на поверхность ПЗС-матрицы изображение диаметром 20 мкм (см. таблицу 1), легко удовлетворяя критерию Найквиста для размера дискретизации (3,3 пикселя на единицу диска Эйри). При такой частоте дискретизации имеется достаточный запас, благодаря чему критерий Найквиста почти удовлетворяется даже с использованием бининга 2×2 пикселя. Напротив, объектив с увеличением 60x (также с числовой апертурой 1,4) проецирует изображение диаметром 12 мкм, что находится непосредственно под нижней границей критерия Найквиста. Кроме того, даже с уменьшенной числовой апертурой, равной 1,3, объектив с увеличением 40x формирует изображение диаметром 8,4 мкм, и для удовлетворения критерию Найквиста требует увеличительной приставки для камеры. Фотодиодная матрица с ячейками более или менее крупных размеров либо соответствует оптическому разрешению микроскопа без промежуточного увеличения, либо, может быть легко модифицирована при помощи специального ПЗС-адаптера с соответствующей оптической системой.
На рисунке 8(b) представлена схема бининга в формате 2×2 пикселя для матрицы, состоящей из 16 пикселей. После накопления фотоэлектронов за время экспозиции, считывающая схема камеры дважды параллельно сдвигает по 4 пикселя за каждый прием. Затем, два последовательных регистра сдвигают накопленные 4-мя пикселями фотоэлектроны (бининг 2×2) на позицию одного пикселя — в выходной модуль, где создаваемое ими (электронами) напряжение считывается усилителем. Аналогично, в результате бининга 4×4 (не показан), перед считыванием сигнала будет происходить сдвиг содержимого всех 16 ячеек матрицы в выходной модуль, тем самым, существенно повышая уровень сигнала и, одновременно, уменьшая уровень шумов. Как уже упоминалось, бининг пикселей является превосходным методом извлечения из шумов слабых сигналов при исследовании меченых флуоресцентными белками живых образцов с низкими уровнями экспрессии, необходимыми для снижения токсических искажений.
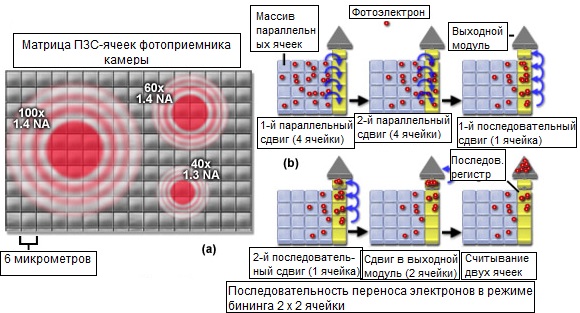
Рис. 8. Разрешающая способность ПЗС-матрицы и бининг ячеек (пикселей)
На практике, для объектива с числовой апертурой 1,4, идеальный размер пикселя результирующего изображения лежит в диапазоне 100 — 120 нанометров. Для преобразования этой величины в соответствующие физические размеры фотодиодов ПЗС-матрицы необходимо знать коэффициент увеличения объектива. Например, чтобы достичь полного оптического разрешения объектива с коэффициентом увеличения 60x и числовой апертурой 1,4, размер фотодиодов приемника должен быть не более 6 мкм (определяется произведением усиления и разрешения). Однако, для объектива с коэффициентом увеличения 100x и той же числовой апертурой, оптимальный размер фотодиода возрастает до 10 мкм. Таким образом, очевидно, что цифровое разрешение конкретной ПЗС-камеры соответствует оптическому разрешению микроскопа только тогда, когда камера должным образом согласована с соответствующим объективом. Подсоединение ПЗС-камеры с 10-микронными фотодиодами к объективу со 100-кратным увеличением даст результирующее изображение с размером пикселя, равным 100 нм. Та же камера с 60-кратным объективом сформирует пиксели размером 167 нанометров, в некоторой степени, ограничивая разрешение регистрируемых изображений. И, напротив, ПЗС с 6-микронными фотодиодами превосходно согласуется с 60-кратным объективом, но будет формировать изображения с избыточной частотой дискретизации, если повернуть револьверный держатель микроскопа и использовать объектив с увеличением 100x. Такого рода избыточная частота дискретизации существенно уменьшает яркость изображения, не улучшая его разрешение.
В связи с вышесказанным, может показаться, что единственно правильное решение для согласования оптической системы микроскопа с пиксельным разрешением фотоприемника состоит в использовании отдельной камеры для каждого объектива. Очевидно, что с практической точки зрения такой подход нереалистичен, и необходимо найти компромисс, позволяющий оптимально использовать одну камеру. В некоторых случаях проблему можно решить, установив между микроскопом и камерой переходник, уменьшающий коэффициент увеличения объектива. Например, соединительный переходник с коэффициентом увеличения 0,6x уменьшит увеличение изображения, проецируемого 100-кратным объективом, до уровня, соответствующего объективу с коэффициентом увеличения 60x. Сегодня рынок предлагает широкий выбор переходников, как для увеличения, так и для уменьшения изображения, проецируемого на фотодиоды ПЗС-матрицы. Что касается сменных цифровых ПЗС-камер (необходимость которых весьма сомнительна), то важно отметить, что, несмотря на простоту снятия этих устройств с микроскопа, желательно, все же, оставлять их на микроскопе — это предотвратит проникновение пыли и соринок внутрь микроскопа, а также их налипание на окно формирователя изображений камеры (эффект, обусловленный статическим электричеством). Очистка окна фотоприемника — чрезвычайно трудная задача, особенно, когда цель состоит в удалении всех до единой частичек пыли.
Табл. 1. Требования к размерам пикселей для согласования ПЗС-камеры с оптическим разрешением микроскопа
|
Объектив
(числовая апертура)
|
Предельное
разрешение
(мкм)
|
Проецируемый
размер
(мкм)
|
Требуемый
размер пикселя
(мкм)
|
|
1x (0,04)
|
6,9
|
6,9
|
3,5
|
|
2x (0,06)
|
4,6
|
9,2
|
4,6
|
|
2x (0,10)
|
2,8
|
5,6
|
2,8
|
|
4x (0,10)
|
2,8
|
11,2
|
5,6
|
|
4x (0,12)
|
2,3
|
9,2
|
4,6
|
|
4x (0,20)
|
1,4
|
5,6
|
2,8
|
|
10x (0,25)
|
1,1
|
11,0
|
5,5
|
|
10x (0,30)
|
0,92
|
9,2
|
4,6
|
|
10x (0,45)
|
0,61
|
6,1
|
3,0
|
|
20x (0,40)
|
0,69
|
13,8
|
6,9
|
|
20x (0,50)
|
0,55
|
11,0
|
5,5
|
|
20x (0,75)
|
0,37
|
7,4
|
3,7
|
|
40x (0,65)
|
0,42
|
16,8
|
8,4
|
|
40x (0,75)
|
0,37
|
14,8
|
7,4
|
|
40x (0,95)
|
0,29
|
11,6
|
5,8
|
|
40x (1,00)
|
0,28
|
11,2
|
5,6
|
|
40x (1,30)
|
0,21
|
8,4
|
4,2
|
|
60x (0,80)
|
0,34
|
20,4
|
10,2
|
|
60x (0,85)
|
0,32
|
19,2
|
9,6
|
|
60x (0,95)
|
0,29
|
17,4
|
8,7
|
|
60x (1,40)
|
0,20
|
12,0
|
6,0
|
|
100x (0,90)
|
0,31
|
31,0
|
15,5
|
|
100x (1,25)
|
0,22
|
22,0
|
11,0
|
|
100x (1,30)
|
0,21
|
21,0
|
10,5
|
|
100x (1,40)
|
0,20
|
20,0
|
10,0
|
Многие, предназначенные для флуоресцентной микроскопии, современные высокоэффективные цифровые камеры оснащаются фотодиодами с размерами от 5 мкм до 16 мкм и встроенной функцией бининга. Как уже упоминалось, бининг позволяет объединять заряды нескольких соседних фотодиодов в более крупный заряд, что эффективно повышает размер пикселя. Используя камеры с фотодиодами размером 6 — 8 мкм, полного оптического разрешения микроскопа можно добиться, как правило, с 60-кратным объективом без бининга, тогда как, бининг фотодиодов в виде матрицы 2×2 можно использовать со 100-кратным объективом для увеличения яркости изображения. Помимо преимущества в виде согласования разрешающих способностей оптической системы и ПЗС-камеры за счет 60-кратного объектива с высоким светопропусканием, описанный метод, в случае использования 100-кратного объектива в сочетании с бинингом (бининг формата 2×2 повышает чувствительность в четыре раза), позволяет получать даже более яркие изображения. В результате, изображения, полученные со 100-кратным объективом и бинингом 2, приблизительно, в два раза ярче (и одинаковы, либо лучше по разрешению) изображений, полученных через объектив с увеличением 60x и без бининга. В тех случаях, когда желательно, или необходимо, иметь повышенную чувствительность, объектив с коэффициентом усиления 60x можно использовать с бинингом 2×2, что в четыре раза повысит яркость изображения, с одновременным ухудшением разрешения, уровень которого, однако, приемлем для большинства исследований с визуализацией живых клеток.









.png)