Введение во флуоресцентную микроскопию
Поглощение и последующее переизлучение света органическими и неорганическими образцами обычно является результатом распространённого физического явления, называемого либо флуоресценцией, либо фосфоресценцией. Испускание света посредством флуоресценции происходит почти одновременно с поглощением возбуждающего света, благодаря относительно малому времени задержки между поглощением и испусканием фотона, которое обычно не превышает микросекундного интервала. При более длительном интервале между поглощением и испусканием света это явление называется фосфоресценцией.
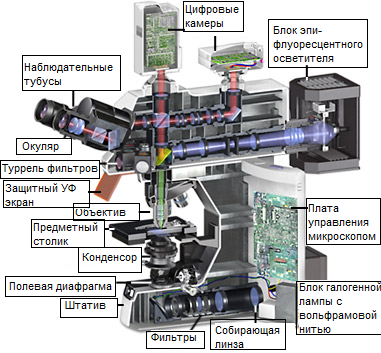
Рис. 1. Эпи-флуоресцентный микроскоп
Впервые флуоресценция была описана в 1852 году британским учёным Джорджем Стоксом, который и ввёл в употребление этот термин при проведении экспериментов с флюоритом (плавиковым шпатом), испускающим красный свет при облучении ультрафиолетом. Стокс заметил, что длина волны флуоресцентного испускания всегда больше длины волны света возбуждения. Первые исследования в 19-м веке показали, что многие образцы (включая минералы, кристаллы, смолы, лекарственное сырьё, масла, хлорофилл, витамины и неорганические соединения) флуоресцируют при облучении их ультрафиолетом. Тем не менее, применение флуорохромов в биологических исследованиях для окрашивания компонентов тканей, бактерий и других болезнетворных организмов началось лишь в 1930-х годах. Некоторые из этих красителей были крайне специфичны и стимулировали развитие флуоресцентной микроскопии.
Благодаря некоторым показателям, трудно достижимым традиционной контрастной оптической микроскопией, флуоресцентная микроскопия стала важным инструментом как в биологических и биомедицинских исследованиях, так и в материаловедении. Применение наборов флуорохромов позволило выделять высоко специфичные клетки и субмикроскопические клеточные компоненты среди не флуоресцирующих веществ. С помощью флуоресцентного микроскопа, на самом деле, можно обнаруживать даже отдельные молекулы. С помощью флуоресцентного мультиокрашивания различные красители могут идентифицировать несколько молекул-мишеней одновременно. И хотя пространственное разрешение флуоресцентного микроскопа ограничено снизу дифракционным пределом, зависящим от специфических характеристик образца, обнаружение флуоресцирующих молекул ниже этого предела вполне возможно.
Многие образцы, будучи облучёнными, демонстрируют автофлуоресценцию (без применения флуорохромов), и это явление широко используется в ботанике, петрологии и полупроводниковой промышленности. И напротив, изучение тканей животных или болезнетворных организмов часто осложнено либо чрезвычайно слабой, либо, наоборот, сильной неспецифичной автофлуоресценцией. Гораздо более важное значение в этом случае имеет внесение в ткани флуорохромов (или флуророфоров), возбуждаемых на определённой длине волны и испускающих свет с необходимой интенсивностью. Флуорохромы являются красителями, которые, самостоятельно прикрепляясь к видимым или невидимым структурам, обладают при этом высокой избирательностью по отношению к мишеням и высоким квантовым выходом (отношением числа испущенных к числу поглощённых фотонов). Бурный рост применения флуоресцентной микроскопии тесно связан с появлением новых синтетических и естественных флуорофоров, имеющих определённые профили интенсивности возбуждения и испускания и «нацеленных» на заданные биологические мишени.
Основы процессов возбуждения и испускания
Принцип работы флуоресцентного микроскопа заключается в облучении образца на длинах волн в необходимом и точно определённом интервале с последующим выделением гораздо более слабой испускаемой флуоресценции из потока возбуждающего света. В хорошо настроенном микроскопе достигать глаза или приёмного устройства должен лишь испускаемый свет, таким образом, чтобы наблюдаемые флуоресцирующие структуры накладывались на высоко контрастный очень тёмный (или чёрный) фон. Темнота фона, в общем, определяет пределы обнаружения, поскольку возбуждающий свет обычно в сотни тысяч, или даже миллионы, раз ярче испускаемой флуоресценции.
На рисунке 1 схематически изображён в разрезе современный эпифлуоресцентный микроскоп, предназначенный для наблюдений как в проходящем, так и в отражённом свете. Вертикальный осветитель, расположенный в центре, на одном конце имеет источник света (обозначенный на схеме как эпископический модуль) и насадку с фильтрами — на другом. В основе конструкции лежит микроскоп, работающий в отражённом свете, длина волны которого больше длины волны возбуждения. Автором вертикального осветителя для флуоресцентной микроскопии в отражённом свете считается Джон С. Плоем (Johan S. Ploem). Многочастотный свет от дуговой лампы или другого источника, проходя через селективный светофильтр возбуждения, преобразуется во флуоресцентном вертикальном осветителе в свет с определённой длиной волны (или в заданном волновом интервале), обычно из ультрафиолетового, синего или зелёного участков спектра. Пропущенный фильтром возбуждения поток отражается от поверхности дихроматического (также называемого дихроичным) зеркала или светоделителя и, пройдя через объектив, освещает образец интенсивным светом. Если образец флуоресцирует, испускаемый свет, собираемый объективом, опять проходит через дихроичное зеркало, после чего фильтруется запирающим (или эмиссионным) фильтром, который блокирует свет на длинах волн возбуждения. Важно заметить, что флуоресценция является единственным в оптической микроскопии режимом, при котором образец после облучения излучает свой собственный свет. Испускаемый свет переизлучается сферически во всех направлениях, независимо от расположения источника облучающего света.
Метод эпифлуоресцентного освещения является преобладающим в современной микроскопии. Вертикальный осветитель отражённого света располагается между тубусами наблюдения и револьверной головкой объективов. Осветитель устроен таким образом, что возбуждающий свет на пути к образу и от образца проходит через один и тот же объектив микроскопа, который в данной конфигурации сначала выступает в качестве конденсора, а на обратном пути собирает испущенный свет флуоресценции. Осветители этого типа имеют несколько преимуществ. Объектив флуоресцентного микроскопа выступает, во-перых, в качестве хорошо настроенного конденсора, а во-вторых, в качестве собирающего свет устройства, с помощью которого формируется изображение. Будучи одним и тем же компонентом, объектив/конденсор всегда превосходно отюстирован. Большая часть возбуждающего света, достигающего образца, проходит сквозь него без взаимодействия и не возвращается на объектив, а освещаемая область ограничена той частью образца, которая наблюдается через окуляры (в большинстве случаев). Если микроскоп правильно сконфигурирован для освещения по Кёллеру, то, в отличие от некоторых методов, усиливающих контраст, при наблюдении на нём доступна полная числовая апертура объектива. Кроме того, он позволяет комбинировать режимы наблюдения в проходящем и отражённом свете, режим формирования цифрового изображения, или выбирать один из них.
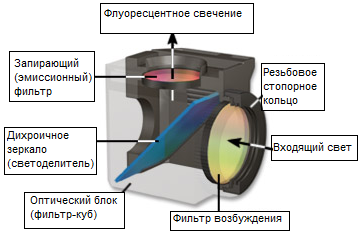
Рис. 2. Флуоресцентные фильтры
Как показано на рисунке 1, на заднем конце вертикального осветителя отражённого света расположен блок дуговой лампы (обычно ртутной или ксеноновой). Распространяясь вдоль осветителя перпендикулярно оптической оси микроскопа, возбуждающий свет проходит сквозь собирающие линзы, регулируемую и центрируемую апертурную диафрагму, а затем через регулируемую центрируемую полевую диафрагму (см. рисунок 1). После этого свет попадает на фильтр возбуждения, где происходит отбор длин волн из требуемого интервала и блокирование остальных длин волн. После прохождения фильтра возбуждения, отобранные длины волн достигают дихроичного светоделительного зеркала, являющегося специальным интерференционным фильтром, эффективно отражающим коротковолновый и эффективно пропускающим длинноволновый свет. Дихроичный светоделитель наклонён под углом 45 градусов по отношению к падающему на него возбуждающему свету и отражает его под углом 90 градусов через объектив оптической системы прямо на образец. Флуоресценция, испускаемая освещённым образцом, собирается объективом, выполняющим теперь уже свою обычную функцию, а именно формирование изображения. Поскольку испускаемые длины волн больше длин волн возбуждения, они проходят через дихроичное зеркало вверх к наблюдательным тубусам или электронному детектору.
Большинство рассеянного возбуждающего света, достигая дихроичного зеркала, отражается им обратно к световому источнику, хотя небольшая его доля может пройти насквозь или поглощается внутренним покрытием зеркала. Но до того, как испущенная флуоресценция достигнет окуляра или детектора, она должна пройти запирающий или заграждающий фильтр Эти фильтры блокируют (заграждают) любой остаточный возбуждающий свет, но пропускают более длинные волны испускаемого света. В большинстве осветителей отражённого света фильтр возбуждения, дихроичное зеркало и запирающий фильтр объединены в оптический блок (часто называемый кубом), как показано на рисунке 2. Современные флуоресцентные микроскопы могут вмещать от четырёх до шести фильтр-кубов (обычно на насадке карусельного или на выдвижного типа; см. рисунок 1) и позволяют пользователю легко устанавливать сменные фильтры возбуждения, запирающие фильтры и дихроичные зеркала.
Конструкция вертикального осветителя должна позволять пользователю настраивать микроскоп для освещения по Кёллеру, при котором обеспечивается яркое и равномерное освещение по всему полю зрения. Откорректированные конденсорные линзы оптической системы обеспечивают сопряжённость изображения центрируемой апертурной диафрагмы с задней апертурой фокусирующего объектива. В современных осветителях, изображение предварительно-сфокусированной, центрируемой полевой диафрагмы является сопряженныи со сфокусированным образом и плоскостью фиксированной диафрагмы окуляра.
Ламповый блок осветителя обычно содержит заграждающий фильтр, блокирующий инфракрасный свет. Сам ламповый блок не должен пропускать наружу ультрафиолетового излучения. Желательно, к тому же, чтобы в него был встроен автоматический выключатель, на случай его открытия во время работы. Ламповый блок должен быть достаточно прочным, чтобы выдержать возможный взрыв дуговой лампы в процессе работы. В современных ламповых блоках гнездо лампы оборудовано регулировочными ручками для центрирования изображения дуговой лампы в задней апертуре объектива (при освещении по Келлеру эти плоскости сопряжены). На пути света, обычно ближе к ламповому блоку, но перед фильтром возбуждения, желательно поставить задвижку, чтобы полностью блокировать возбуждающий свет, если не ведётся наблюдение образца. К тому же, в оснащение осветителя должны входить нейтральные светофильтры (на насадке барабанного, карусельного или выдвижного типа) для того, чтобы иметь возможность понизить интенсивность возбуждающего освещения.
Стоксов сдвиг
При переходе электронов из возбуждённого в основное состояние теряется колебательная энергия. В результате этой потери энергии спектр испускания возбуждённого флуророфора обычно сдвигается в сторону более длинных волн в сравнении со спектром поглощения или возбуждения (необходимо помнить, что длина волны обратно пропорциональна её энергии). Это известное явление называется правилом Стокса или стоксовым сдвигом. При увеличении стоксова сдвига становится легче разделять возбуждающий и испускаемый свет с помощью комбинаций флуоресцентных светофильтров.
Пик интенсивности испускания флуророфора обычно ниже пика интенсивности его поглощения и приходится на волну с большей длиной. Кривая испускания (спектральная кривая) часто является зеркальным (или близко к этому) отображением кривой возбуждения, но сдвинутой в сторону более длинных волн, как показано на рисунке 3, где представлен полезный своими спектральными характеристиками краситель Alexa Fluor 555, который поглощает в жёлто-зелёной, а испускает в жёлто-оранжевой области. Для достижения максимальной интенсивности флуоресценции, флуророфор (часто называемый красителем) возбуждается на длинах волн, близких к пику кривой возбуждения или приходящихся на самый её пик, при этом испускаемый свет регистрируется в максимально широком диапазоне, включающем пик испускания. Отбор возбуждающих и испускаемых длин волн производится с помощью интерференционных фильтров (рисунок 2). В дополнение следует отметить, что спектральные характеристики оптической системы микроскопа также зависят от коэффициентов пропускания стекла (на которые влияют просветляющие покрытия), количества линз и зеркал и чувствительности детекторов.
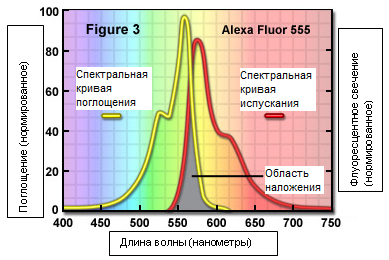
Рис. 3. Кривые поглощения и испускания флуорофора
Эффективность разделения и регистрации длин волн возбуждения и испускания достигается во флуоресцентной микроскопии правильным выбором светофильтров, блокирующих или, наоборот, пропускающих свет определённых длин волн в ультрафиолетовой, видимой и ближней инфракрасной области спектра. Контроль возбуждающего света производится в вертикальных флуоресцентных осветителях благодаря тому, что в их конструкции предусмотрено использование легко сменяемых фильтров (нейтральных и интерференционных светофильтров возбуждения), вставляемых на пути света к образцу и на обратном пути между образцом и тубусами наблюдения или системой приёма сигнала. Ввиду низкой интенсивности флуоресцентного свечения (о чём говорилось выше), необходимо чтобы источник возбуждающего света имел достаточную яркость для максимально возможного усиления слабого испускаемого света, а также, чтобы флуорохромы обладали соответствующими поглощательными характеристиками и квантовым выходом. Это, возможно, является ключевыми критериями флуоресцентной микроскопии.
Эффективность поглощения отдельным флуророфором фотона возбуждающего света является функцией эффективного молекулярного сечения, а вероятность такого события называется коэффициентом поглощения. Бо?льшие значения коэффициента поглощения говорят о том, что поглощение фотона (или кванта) в данном интервале длин волн более вероятно. Квантовым выходом обозначается отношение числа испущенных к числу поглощенных квантов (обычно оно лежит в интервале от 0,1 до 1,0). То, что квантовый выход принимает значения меньшие 1, является следствием потери энергии безызлучательным способом, например через тепло или фотохимическую реакцию, когда не происходит её переизлучения, приводящего к флуоресценции. Коэффициент поглощения, квантовый выход, средняя сила света, а также время высвечивания являются важными факторами, влияющими на интенсивность флуоресценции и определяющими целесообразность применения этого метода.
Фединг, тушение и фотообесцвечивание
Целый ряд условий может влиять на вероятность флуоресцентного переизлучения, часто приводя к падению интенсивности флуоресценции. Общим термином для обозначения уменьшения интенсивности флуоресцентного испускания является фединг, охватывающий все явления, которые для более подробного описания могут быть разделены на явления тушения и фотообесцвечивания. Фотообесцвечиванием называется необратимый распад флуоресцентных молекул в возбуждённом состоянии, вызванный их взаимодействием с молекулярным кислородом до момента испускания. Это явление используется в методе восстановления флуоресценции после фотообесцвечивания (FRAP), очень эффективном при изучении диффузионных свойств и движения биологических макромолекул. В основе метода лежит фотообесцвечивание лазерным пучком чётко определённой области в образце с последующим наблюдением скорости и характера восстановления флуоресценции в фотообесцвеченной области. Связанный с этим метод затухания флуоресценции в обесцвеченных изображениях (FLIP) применяется для исследования уменьшения флуоресценции в областях, прилегающих к фотообесцвеченной области. Как и FRAP, этот метод является эффективным инструментом в исследовании подвижности молекул и динамики в живых клетках.
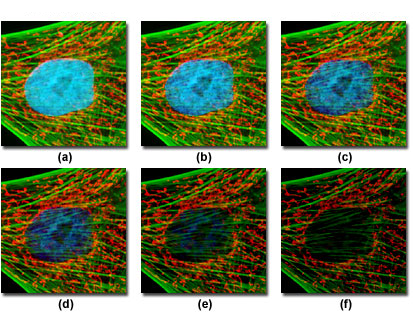
Рис. 4. Скорость фотообесцвечивания мультиокрашенных образцов
На рисунке 4 представлен типичный пример фотообесцвечивания (фединга), наблюдаемого в серии цифровых изображений мультиокрашенной культуры фибробластов кожи индийского мунтжака, снятых в различные моменты времени. Ядра были окрашены дериватом бис-бензимидазола (хёхст 33258, синее свечение), а митохондрии и актиновый цитоскелет — красителем MitoTracker Red CMXRos (красное свечение) и дериватом фаллоидина, присоединённым к Alexa Fluor 488 (зелёное свечение), соответственно. Снимки производились через каждые две минуты, а комбинация флуоресцентных светофильтров была настроена таким образом, чтобы возбуждение всех трёх флуорофоров происходило одновременно, при одновременной регистрации комбинированных испускаемых сигналов. На рисунке 4(а) видно, что интенсивность всех трёх флуророфоров относительно высока, но интенсивность хёхста (синий) начинает быстро падать уже через две минуты и почти совсем пропадает через 6–8 минут. Красители митохондрий и актина оказываются более устойчивыми к фотообесцвечиванию, но и их интенсивность значительно падает за время наблюдения (10 минут).
Релаксация из возбуждённого состояния путём тушения, приводящая к падению интенсивности флуоресценции, происходит различными безизлучательными способами и часто возникает из-за окислителей или из-за присутствия солей, тяжёлых металлов и галогенных соединений. В некоторых случаях тушение происходит как результат передачи энергии другой молекуле (именуемой акцептором), которая находится близко к возбуждённому флуророфору (донору). Это явление называется резонансным переносом энергии флуоресценции (FRET). Именно этот механизм стал основой эффективного метода изучения молекулярных взаимодействий и ассоциаций на расстояниях, значительно меньших разрешающей способности оптических микроскопов.
Флуоресцентные источники света
Неблагоприятным следствием низкой интенсивности испускания в большинстве приложений флуоресцентной микроскопии является низкое число фотонов, достигающих окуляра, либо приёмного устройства. В большинстве случаев, эффективность собираемости фотонов в оптических микроскопах меньше 30 процентов, а концентрации многих флуророфоров на оптическом пути меняются от микромолярных до наномолярных концентраций. Чтобы интенсивность возбуждающего света была достаточной для регистрации флуоресценции, необходимы мощные компактные источники света, такие как небольшие дуговые лампы с высокой энергией излучения. Наиболее распространёнными являются ртутные лампы мощностью от 50 до 200 ватт и ксеноновые лампы мощностью от 75 до 150 ватт (см. рисунок 5). Эти лампы обычно питаются от внешнего источника постоянного тока, достаточного для того, чтобы зажечь дуговой разряд через ионизацию паров высокого давления и поддерживать его горение с минимальным мерцанием.
Внешний источник питания дуговой лампы микроскопа обычно снабжён таймером для отслеживания количества отработанных часов. Дуговые лампы теряют световую отдачу и часто разрушаются при эксплуатации дольше установленного срока службы (200–300 часов). Ртутные лампы не обеспечивают равномерной интенсивности в спектральном диапазоне от УФ до ИК. Максимум их интенсивности приходится на ближний ультрафиолет. Отчётливые пики интенсивности возникают на 313, 334, 365, 406, 435, 546 и 578 нанометрах. На других длинах волн видимого спектра интенсивность стабильна, хотя и не так высока (но всё же достаточна для большинства приложений). Но мощность лампы сама по себе не является определяющим для эффективности освещения параметром. И напротив, существенным параметром, который в первую очередь должен приниматься во внимание, является средняя светимость с учётом яркости источника, геометрии дуги и углового распределения излучения.

Рис. 5. Дуговые флуоресцентные лампы
В последние несколько лет оптическая микроскопия переживает подъём в применении лазерных источников света, особенно аргоновых ионных и аргоново-криптоновых (ионных) лазеров. Преимущества этих лазеров заключаются в их небольшом размере, малой расходимости пучка, высокой степени монохроматичности и высокой средней светимости. Они получили широкое применение в сканирующей конфокальной микроскопии, которая стала мощным инструментом создания высоко контрастных флуоресцентных изображений за счёт исключения внефокусных засветок, идущих из фокальной плоскости образца. В конфокальных микроскопах это достигается благодаря сканированию образца фокальной точкой или линией с одновременным формированием изображения через сопряжённую апертуру. Оптические срезы образцов могут храниться в памяти компьютера микроскопа и реконструироваться в окончательное изображение, отображаемое на мониторе.
Обозначения фильтров
Общая терминология, принятая для обозначения комбинаций фильтров во флуоресцентной микроскопии, стала весьма запутанной из-за различных аббревиатур и кодов, применяемых разными производителями для маркировки своих фильтров. В принципе, существуют три основных категории фильтров: фильтры возбуждения (часто просто называемые возбудителями), запирающие (эмиссионные) фильтры и дихроичные светоделители (или дихроичные зеркала). Прежде флуоресцентные светофильтры состояли исключительно из цветного стекла или желатина, вставленного между двумя стеклянными пластинами. Однако сегодня имеет место тенденция к производству высокочувствительных фильтров с интерференционной оптикой для пропускания или задержки света строго определённых длин волн, обладающей, к тому же, высоким коэффициентом пропускания. Дихроичные светоделители являются специальными интерференционными фильтрами, предназначенными для отражения или пропускания света определённых длин волн, помещаемых на световом пути под углом 45 градусов (см. рисунки 1и 2). Запирающие фильтры изготавливаются на основе либо цветного стекла, либо интерференционных покрытий (либо их комбинации).
Для обозначения характеристик фильтров возбуждения производителями применяется различная аббревиатура. Ультрафиолетовое стекло, например, обозначается как UG, а синее стекло — BG. На узкополосных фильтрах часто можно встретить обозначение KP (K от немецкого «kurz», что переводится как «короткий») или просто SP. Интерференционные фильтры сейчас маркируются некоторыми производителями аббревиатурой IF. Узкополосные интерференционные фильтры возбуждения особенно эффективны при малом стоксовом сдвиге.
Сокращения и аббревиатуры для запирающих фильтров бывают следующими: LP или L для широкополосных фильтров, Y или GG для жёлтого (от немецкого «gelb» — «жёлтый») стекла, R или RG для красного стекла, OG или O для оранжевого стекла, K для щелевых фильтров (от немецкого «kante» — край), и BA для запирающих фильтров. Если в маркировке фильтра стоит число, как например ВА515, оно обозначает длину волны (в нанометрах), на которой он имеет половину от максимального коэффициента пропускания.
Дихроичные светоделители также маркируются различными аббревиатурами: CBS обозначает хроматический светоделитель, DM — дихроичное зеркало, TK — щелевой делитель (от немецкого «teiler kante»), FT — делитель цвета (от немецкого"farb teiler») и RKP — узкополосный отражатель. Все эти обозначения являются взаимозаменяемыми; кроме того, оптическое стекло всех современных дихроичных светоделителей всегда покрывается интерференционными покрытиями (а не органическими или металлическими красящими веществами). Эти тонкие интерференционные плёнки обладают высоким коэффициентом отражения коротких волн и высоким коэффициентом пропускания длинных волн. Дихроичные светоделители наклонены под углом 45 градусов по отношению свету возбуждения, падающему на оптический блок через флуоресцентный осветитель отражённого света. Их основной функцией является перенаправление определённых (более коротких) возбуждающих волн на объектив и на расположенный за ним образец. Эти специальные фильтры имеют и дополнительные функции, заключающиеся в пропускании более длинных волн флуоресценции к запирающему фильтру и в отражении рассеянного возбуждающего света обратно в направлении лампового блока.
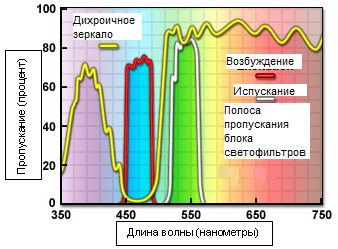
Рис. 6. Среднеполосный фильтр синего возбуждения Nikon B-2E
На рисунке 6 представлены кривые пропускания для комбинации типичных флуоресцентных светофильтров, применяемых в современных микроскопах. Спектр фильтра возбуждения (красная кривая) демонстрирует высокую степень пропускания (приблизительно 75 процентов) в диапазоне от 450 до 490 нанометров с центральной длиной волны (CWL) 470 нанометров. Дихроичное зеркало (жёлтая кривая) отражает волны в спектральном диапазоне фильтра возбуждения, но пропускает, с относительно высоким коэффициентом, более короткие и более длинные волны. Необходимо заметить, что нулевое пропускание дихроичного зеркала соответствует 100 процентному отражению. Отчётливый провал в кривой пропускания между 450 и 500 нанометрами, который соответствует пику отражения, служит для перенаправления волн из полосы пропускания фильтра возбуждения под углом 90 градусов на образец. Последним звеном в этой последовательности является эмиссионный или запирающий фильтр (белая кривая), который пропускает волны в зелёном участке видимого спектра в интервале от 520 до 560 нанометров. Для обеспечения почти полного разделения отражённых и пропущенных волн границы полос отражения и пропускания различных накладываемых друг на друга спектров должны быть как можно круче. Синусоидальная часть кривой спектра дихроичного зеркала, называемая звоном, является результатом процесса нанесения тонких плёнок. Высокая эффективность этой комбинации фильтров — пример значительных успехов в технологии тонких покрытий интерференционных фильтров.
В основе системы условных обозначений, применяемых компанией Nikon, лежат смешанные термины, появившиеся в начале 1990-х годов. В то время все дополнительные комбинации фильтров Nikon производились методом напыления твёрдых покрытий, но сегодня при производстве многих фильтров, применяются передовые методы мягкого покрытия. И хотя мягкие покрытия более чувствительны к влажности и нагреву и требуют более аккуратного (по сравнению с твёрдыми покрытиями) обращения, они демонстрируют более высокие значения оптической плотности и обеспечивают бо?льшую лёгкость в тонкой настройке специфичных полос пропускания. Понимание условных обозначений комбинаций фильтров Nikon позволяет быстро подбирать необходимые фильтры для специфичных флуророфоров.
Первая буква в принадлежащей компании Nikon системе буквенно-цифровых обозначений указывает на область спектра возбуждения (например, UV, V, B, и G являются сокращениями от английских слов «ultraviolet» — ультрафиолетовый, «violet» — фиолетовый, «blue» — синий, и «green» — зелёный, соответственно). Число, следующее за кодировкой спектра возбуждения, обозначает ширину полосы пропускания фильтра возбуждения: 1 соответствует узкополосному возбуждению, 2 — среднеполосному, и 3 — широкополосному возбуждению. И, наконец, одна или несколько букв, следующих за числом, соответствующим ширине полосы возбуждения, обозначают характеристики запирающего фильтра. Буква A указывает на стандартный широкополосный запирающий фильтр с самой низкой длиной волны отсечки, B обозначает широкополосный запирающий фильтр, имеющий более высокую волну отсечки. Обозначение E (от английского «enhanced» — усиленный) в полосовых эмиссионных фильтрах указывает на улучшенные характеристики в смысле сокращения интерференционного взаимодействия разделяемых сигналов. Обозначение E/C указывает на комбинацию мягких интерференционных покрытий, разработанных специально для работы с такими специфическими красителями, как DAPI, FITC, TRITC и техасский красный.
Флуоресцентный световой баланс
Оценка световых потоков в типичном флуоресцентном микроскопе позволяет в общих чертах составить представление об ограничениях, которые неизбежно возникнут при формировании цифровых изображений или при визуальном наблюдении образцов. В качестве источника облучения для нашей оценки возьмём стандартную 75-ваттную ксеноновую дуговую лампу, средняя плотность светового потока которой приблизительно равна 400 канделам на квадратный миллиметр (другие источники представлены в таблице 1). При направлении излучаемого света на 490-нанометровый интерференционный фильтр (с полосой пропускания 10 нанометров и коэффициентом пропускания 75 процентов) через него пройдёт около 2 милливатт выходного потока лампы. После отражения от дихроичного зеркала с коэффициентом 0,9 световой поток в 1,8 милливатт направляется к задней апертуре объектива микроскопа в качестве возбуждающего пучка.
Для объектива кратностью 100х с числовой апертурой 1,4 освещённая область образца составит 12×10•E(-6) квадратных сантиметров, если диаметр поля зрения считать равным приблизительно 40 микрометрам. Тогда световой поток, падающий на образец, будет около 150 ватт на квадратный сантиметр, что соответствует плотности потока 3.6×10•E(20) фотонов на квадратный сантиметр. Таким образом, интенсивность освещения образца примерно в 1000 раз больше интенсивности освещения земной поверхности в обычный солнечный день.
Флуоресцентное свечение при таком световом потоке зависит от поглощательных и эмиссионных свойств флуророфора, его концентрации в образце и длине оптического пути образца. Математически производимая флуоресценция (F) описывается уравнением:
F = σ • Q • I
где σ — сечение молекулярного поглощения, Q — квантовый выход, а I — падающий световой поток, рассчитанный выше. Предполагая, что флюоресцеин является флуророфором с сечением поглощения (σ) 3×10•E(-16) квадратных сантиметров, получаем Q равным 0.99, что приводит к флуоресценции F в 100000 фотонов в секунду на одну молекулу. При концентрации красителя в 1 микромоль на литр, равномерно распределённом в диске диаметром 40 и толщиной 10 микрометров (объём, равный 12 пиколитрам), получаем приблизительно 1.2×10•E(-17) молей красителя или 7,2 миллиона молекул на оптическом пути. При одновременном возбуждении всех молекул скорость флуоресценции составит 7,2×10•E(11) фотонов в секунду (что является произведением F и числа молекул красителя). Возникает вопрос: сколько испущенных фотонов будет зарегистрировано, и как долго может продолжаться такая скорость испускания?
Табл. 1. Плотность световой энергии различных источников света
|
Лампа
|
Ток
(амперы)
|
Световой поток
(люмены)
|
Средняя яркость
(кд/мм2)
|
Размер дуги
(ВхШ)
(миллиметры)
|
|
Ртутная лампа (100 ватт)
|
5
|
2200
|
1700
|
0.25 x 0.25
|
|
Ксеноновая лампа (75 ватт)
|
5.4
|
850
|
400
|
0.25 x 0,50
|
|
Ксеноновая лампа (500 ватт)
|
30
|
9000
|
3500
|
0,30 x 0,30
|
|
Галогенная лампа с вольфрамовой нитью
|
8
|
2800
|
45
|
4,2 x 2,3
|
Эффективность регистрации фотонов определяется эффективностью их собирания и квантовым выходом детектора. Объектив с числовой апертурой 1,4 и стопроцентным пропусканием (что является нереальным условием) имеет максимальную эффективность собирания фотонов, ограниченную углом приёма около 30 процентов. Коэффициент пропускания дихроичного зеркала равен 85 процентам, а запирающего фильтра — 80 процентам. Результирующая эффективность собирания составляет в этом случае 20 процентов или 140 миллиардов фотонов в секунду. Если в качестве детектора взять традиционный прибор с зарядовой связью (ПЗС), его квантовый выход на волне зелёного флюоресцеина (525 нанометров) составит 50 процентов. Таким образом, детектироваться будут 70 миллиардов фотонов в секунду, или около 10 процентов от испускаемых при флуоресценции. Даже идеальным детектором (со 100-процентным квантовым выходом) может улавливаться только около 20 процентов фотонов флуоресценции.
Длительность флуоресцентного свечения зависит от скорости разрушения флуророфоров, являющегося следствием фотообесцвечивания. Измерения показывают, что каждая молекула флюоресцеина в кислородосодержащем солевом растворе до своего разрушения успевает испустить около 36000 фотонов. В безкислородном окружении скорость фоторазрушения сокращается примерно в десять раз. Таким образом, молекула флюоресцеина может дать 360000 фотонов. В совокупности все красители в нашем примере (7,2 миллиона молекул) способны испустить минимум 2,6×10•E(11) и максимум 2,6×10•E(12) фотонов. При скорости испускания одной молекулой 100000 фотонов в секунду (согласно вышеприведённым оценкам), получаем длительность флуоресцентного свечения до фоторазрушения равной от 0,3 до 3 секунд. В случае регистрации 10 процентов от числа испущенных фотонов сигнал детектора будет составлять 7,2×10•E(10) электронов в секунду.
Таким образом, если ПЗС имеет 1000×1000-пиксельную камеру, этот сигнал будет распределён среди одного миллиона светочувствительных элементов, то есть приблизительно по 72000 электронов на каждый из них. Для научно-исследовательского ПЗС с 9-микрометровыми светочувствительными элементами зарядовая ёмкость составляет около 80000 электронов, а шум считывания меньше 10 электронов. В этом случае отношение сигнал-шум будет, в основном, определяться фотонным флуктуационным шумом, равным квадратному корню сигнала, то есть около 268. Почти во всех случаях такой высокий уровень сигнала может продолжаться лишь короткое время, до наступления фоторазрушения. Для продления времени наблюдения большинство микроскопистов сокращает интенсивность облучающего потока, чтобы возбуждалась, а следовательно, и разрушалась только часть из общего числа молекул флуророфора. Таким образом, отношение сигнал-шум редко достигает теоретического максимума и обычно во флуоресцентной микроскопии лежит в диапазоне от 10 до 20.
Детектирование отдельных молекул
В идеальных условиях, часто бывает возможно зарегистрировать флуоресцентное свечение отдельной молекулы, если, конечно, оптический фон и шум детектора достаточно низки. Как говорилось выше, одна молекула флюоресцеина до своего разрушения фотообесцвечиванием может испустить до 300000 фотонов. При 20-процентной собираемости и эффективности детектирования будут зарегистрированы около 60000 фотонов. Применяя для экспериментов такого рода ПЗС на основе лавинных фотодиодов или электронного умножения, исследователям удавалось следить за поведением отдельных молекул в течение секунд и, даже, минут. Главной проблемой в таких случаях является подавление шума оптического фона. Из-за того, что многие материалы, применяемые в конструкции микроскопических линз и фильтров, проявляют определенную автофлуоресценцию, первоначальные усилия были направлены на производство компонентов с малой флуоресценцией. Однако, вскоре стало очевидным, что при использоваии во флуоресцентной микроскопии метода полного внутреннего отражения (ПВО, или TIR в английской аббревиатуре), необходимое сочетание низкого фона и высоко интенсивного потока возбуждающего света может быть достигнуто.
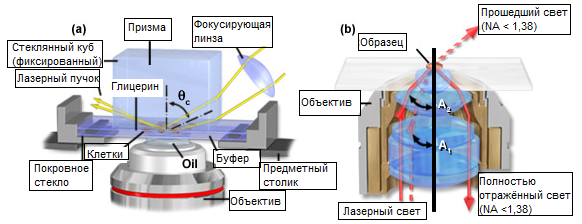
Рис. 7. Конфигурации инвертированного и ФМПВО (TIRF) микроскопов
Флуоресцентная микроскопия полного внутреннего отражения (ФМПВО или TIRFM в английской аббревиатуре) использует явление нераспространяющейся или быстрозатухающей волны, которая возникает при полном внутреннем отражении на границе двух сред с разными показателями преломления.
Схема с применением внешнего источника света представлена на рисунке 7(а). В этом методе пучок света (обычно расширенный лазерный пучок) проходит через призму с высоким показателем преломления (как у стекла или сапфира), прилегающую либо к стеклу, либо к водному раствору с более низким показателем преломления. Если свет направляется на призму под углом, большим критического, пучок будет полностью отражён от границы раздела. Явление отражения вызывает на поверхности раздела нераспространяющуюся волну, а именно, происходит генерация электромагнитного поля, проникающего в среду с меньшим показателем преломления на расстояние не большее 200 нанометров. Интенсивность света в нераспространяющейся волне достаточна для возбуждения флуророфоров, но из-за её чрезвычайно малой глубины, объём возбуждения очень мал. Результатом этого является низкоуровневый фон, поскольку объём образца, подвергшийся облучению, ничтожно мал (только та его часть, которая находится от поверхности в пределах 200-нанометрового расстояния).
Флуоресцентная микроскопия полного внутреннего отражения может быть реализована и с использованием модифицированного метода эпи-освещения, применяемого в широкопольной микроскопии (как показано на рисунке 7(b)). Для этого метода требуются объективы с очень высокой числовой апертурой (по крайней мере, 1,4, но желательно — от 1,45 до 1,6) и частичное освещённое поле микроскопа, что достигается с помощью небольшого пятна или, для большей равномерности освещения, тонкого кольца, блокирующего часть светового потока. Для достижения критического угла, за которым наступает полное внутреннее отражение, необходимо, чтобы иммерсионная среда в линзах и покровное стекло микроскопа имели высокий показатель преломления. Как показано на рисунке 7(b), световые лучи, выходящие из передней линзы под углом меньшим критического (на рисунке он обозначен A(1)), уже не возвращаются в микроскоп. При достижении критического угла или его превышении (угол A(2) на рисунке 7(b)) происходит полное внутреннее отражение.
Для получения дополнительной информации при исследованиях, с методом полного внутреннего отражения часто сочетаются другие популярные передовые методы флуоресценции, такие как резонансный перенос энергии флуоресценции (FRET), восстановление флуоресценции после фотообесцвечивания (FRAP), а также спектроскопия. В сочетании, эти методы являются мощным инструментом в изучении отдельных флуророфоров и флуоресцентно окрашенных молекул. Преимущества изучения отдельных молекул только сейчас начинают осознаваться. Таким образом, сегодня диапазон исследований оптической микроскопии — от отдельных молекул до целых животных.
Заключение
Современные флуоресцентные микроскопы сочетают в себе мощь высококачественных оптических компонентов с компьютеризированным управлением и формированием изображений цифровым способом, что позволяет достигать уровня сложности, который далеко превосходит простое визуальное наблюдение. Сегодня микроскопия в значительной степени зависит от электронных способов формирования изображения, позволяющих быстро получать информацию при низких уровнях световых сигналов или на визуально не регистрируемых длинах волн. Эти технические усовершенствования являются не просто элементами внешнего оформления, но существенными компонентами оптического микроскопа, как сложной измерительной системы.
Время, когда оптическая микроскопия было чисто описательной дисциплиной или интеллектуальной игрушкой прошло. Сегодня получение оптического изображения является только первым шагом в анализе данных. Этот первый шаг осуществляется микроскопом в соединении с электронными детекторами, процессорами изображений, дисплеями, которые могут рассматриваться как расширение системы формирования изображений. Применяемое уже повсеместно компьютеризированное управление фокусировкой, положением предметного столика, оптическими компонентами, затворами, фильтрами и детекторами позволяет проводить такие манипуляции во время эксперимента, которые были просто невозможны для человека при работе на механических микроскопах. Все более возрастающее использование оптоэлектроники во флуоресцентной микроскопии привёло к разработке оптических пинцетов для манипулирования субклеточными структурами и частицами, к наблюдению отдельных молекуле, а также к появлению широкого круга сложнейших спектроскопических приложений.
Комбинации флуоресцентных фильтров
Комбинации эпи-флуоресцентных интерференционных и поглощающих фильтров помещаются в фильтр-кубы (или оптические блоки) и включают в себя фильтр возбуждения, дихроичный светоделитель (часто называемый зеркалом) и запирающий (или эмиссионный) фильтр, как показано на рисунке 1(а). Это руководство может быть полезно при подборе комбинации фильтров, соответствующей поглощательным и испускательным спектральным характеристикам хромофоров, применяемых в широкопольной флуоресцентной микроскопии. Спектральные кривые типичной комбинации высокопроизводительных полосовых фильтров в синем диапазоне возбуждения представлены на рисунке 1(b). Комбинации флуоресцентных фильтров компании Nikon поставляются с узкополосными, среднеполосными и широкополосными фильтрами возбуждения и соответствующими им эмиссионными фильтрами с определённой или широкой полосой пропускания.
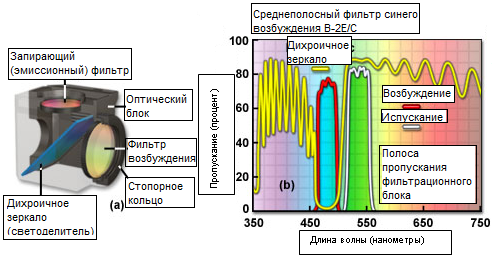
Рис. 8. Спектральные кривые блока фцлуоресцентных светофильтров
Ультрафиолетовое возбуждение — в набор флуоресцентных фильтров ультрафиолетового возбуждения компании Nikon входят четыре тщательно сбалансированных комбинации, в которые включены обычные полосовые или широкополосные эмиссионные (запирающие) фильтры, способные избирательно пропускать флуоресцентное свечение в узком или широком диапазоне синего, зелёного и красного участков видимого спектра. Эти комбинации фильтров охватывают диапазон возбуждения от 330 до 380 нанометров с шириной полосы пропускания 10, 40 и 50 нанометров. В три комбинации входит одно и то же дихроичное зеркало, а в четвертой оно имеет более низкую волну отсечки для совпадения с узкой полосой возбуждения. Комбинации ультрафиолетовых фильтров включают эмиссионные фильтры либо с заданной, либо с широкой полосой пропускания.
Фиолетовое возбуждение — в набор флуоресцентных фильтров фиолетового возбуждения компании Nikon входят три комбинации, в которые включены обычные полосовые или широкополосные эмиссионные (запирающие) фильтры, способные избирательно пропускать флуоресцентное свечение в узком или широком интервале синего, зелёного и красного участков спектра. Эти комбинации фильтров охватывают диапазон возбуждения от 379 до 420 нанометров с шириной полосы пропускания 10, 22 и 40 нанометров. В две комбинации входит одно и то же дихроичное зеркало, а в третьей оно имеет более низкую волну отсечки для совпадения с полосой возбуждения на более коротких волнах.
Сине-фиолетовое возбуждение — в набор флуоресцентных фильтров сине-фиолетового возбуждения компании Nikon входят четыре комбинации, в которые включены обычные полосовые или широкополосные эмиссионные (запирающие) фильтры, способные избирательно пропускать флуоресцентное свечение в узком или широком интервале голубого, зелёного и красного участков видимого спектра. Эти дополнительные наборы фильтров охватывают диапазон возбуждения от 400 до 446 нанометров с шириной полосы пропускания 10, 20 и 40 нанометров. В три комбинации входит одно и то же дихроичное зеркало, а в четвертой оно имеет более высокую волну отсечки (на 5 нанометров) для соответствия другим компонентам.
Синее возбуждение — набор флуоресцентных фильтров синего возбуждения компании Nikon состоит из шести сбалансированных комбинаций, в которые включены обычные полосовые или широкополосные эмиссионные (запирающие) фильтры, способные избирательно пропускать флуоресцентное свечение в узком или широком интервале зелёного, жёлтого, красного и инфракрасного участков спектра. Эти комбинации фильтров охватывают диапазон возбуждения от 420 до 495 нанометров с шириной полосы пропускания 20, 30, 40 и 70 нанометров. В пять комбинаций входит одно и то же дихроичное зеркало, а в шестой оно имеет более низкую волну отсечки для увеличения принимаемого сигнала. Все полосные запирающие фильтры для фильтрационных наборов синего возбуждения компании Nikon имеют спектральную ширину 40 нанометров. Один из фильтров (B-3A) разработан для применения с освещением галогенной лампой с вольфрамовой нитью.
Зелёное возбуждение — набор флуоресцентных фильтров зелёного возбуждения компании Nikon состоит из шести блоков, в которые включены обычные полосовые или широкополосные эмиссионные (запирающие) фильтры, способные избирательно пропускать флуоресцентное свечение в узком или широком интервале жёлтого, оранжевого, красного и ближнего инфракрасного участков спектра. Эти комбинации фильтров охватывают диапазон возбуждения от 510 до 560 нанометров с шириной полосы пропускания 10, 25, 30 и 50 нанометров (включая узкую, среднюю и широкую полосы возбуждения). В три комбинации входит одно и то же дихроичное зеркало (565 нанометров), а остальные три имеет волну отсечки с большей длиной (570 и 575 нанометров). Два из шести фильтрационных наборов компании Nikon для зелёного возбуждения включают полосовые запирающие фильтры с полосами пропускания 60 и 75 нанометров.
Жёлтое возбуждение — набор флуоресцентных фильтров жёлтого возбуждения компании Nikon состоит из двух сбалансированных комбинаций, в которые включены эмиссионные (запирающие) фильтры с одной определённой полосой пропускания, способные избирательно пропускать флуоресцентное свечение в оранжевом и красном участках спектра. Эти дополнительные комбинации фильтров охватывают диапазон возбуждения от 532 до 587 нанометров с шириной полосы пропускания 40 и 55 нанометров. В обе комбинации входит одно и то же дихроичное зеркало (с отсечкой на 595 нанометрах). Два фильтрационных набора компании Nikon для жёлтого возбуждения включают полосовые запирающие фильтры с полосами пропускания 60 и 75 нанометров.
Красное возбуждение — комбинация флуоресцентных фильтров компании Nikon для красного возбуждения представлена одним блоком, который включает полосовой эмиссионный (запирающий) фильтр, способный избирательно пропускать флуоресцентное свечение в дальнем красном и ближним инфракрасном участках спектра. Середина полосы пропускания запирающего фильтра приходится на 700 нанометров, а её ширина — 75 нанометров (от 663 до 738 нанометров). Широкая 60-нанометровая полоса возбуждения от 590 до 650 нанометров захватывает оранжевые и красные длины волн. В комбинацию Cy5 HYQ входит дихроичное зеркало с отсечкой на 660 нанометрах, что на 10 нанометров больше отсечки полосы возбуждения.
Возбуждение жёлтого флуоресцентного белка (YFP) — для жёлтого флуоресцентного белка компанией Nikon разработана одна высококачественная сбалансированная комбинация, которая расширяет возможности регистрации флуоресцентного белка (обеспеченные тремя фильтрационными наборами для зелёного флуоресцентного белка (GFP)) благодаря использованию фильтров для вариантов GFP с большей длиной волны (YFP и EYFP). В блок фильтров YFP HYQ входят фильтры возбуждения и эмиссионные (запирающие) фильтры с относительно узкой полосой пропускания, разработанные специально для соответствия спектральным характеристикам жёлтого флуоресцентного белка с усиленной флуоресценцией (усиленного YFP), что позволяет оценить флуоресценцию от дериватов YFP отдельно от остальных флуоресцентных белков.
Возбуждение в двух полосах — набор двухполосных флуоресцентных фильтров Nikon состоит из трёх тщательно сбалансированных комбинаций, включающих двухполосные фильтры (возбуждения и эмиссионные (запирающие) фильтры), объединённые в одном блоке, избирательно пропускающем флуоресцентное свечение от двух флуорофоров одновременно. Каждый из фильтрационных блоков оптимально сочетается со специфичной флуорохромной парой, хотя также эффективно может работать и с другими парами флуоресцентных красителей, имеющих те же спектральные профили поглощения и испускания. Благодаря точному подбору полос, с крутыми межполосными переходами между участками отражения и пропускания, различные сигналы возбуждения и испускания разделяются с минимально перекрывающейся интерференцией.
Возбуждение в трёх полосах — трёхполосные флуоресцентные фильтры Nikon представлены двумя сбалансированными блоками, включающими трёхполосные фильтры (возбуждения и эмиссионные (запирающие) фильтры), избирательно пропускающие флуоресцентное свечение от трёх флуорофоров одновременно. Каждый из фильтрационных блоков оптимально сочетается со специфичным набором из трёх флуорохромов, хотя также эффективно может работать и с другими комбинациями красителей, имеющих те же спектральные профили поглощения и испускания. Благодаря точному подбору полос, с крутыми межполосными переходами между участками отражения и пропускания, различные сигналы возбуждения и испускания разделяются с минимальной интерференцией между ними. Тройные кубы.
HYQ кубы — HYQ комбинации флуоресцентных фильтров Nikon представлены четырьмя тщательно сбалансированными высококачественными блоками, каждый из которых включает полосные эмиссионные (запирающие) фильтры для избирательного пропускания флуоресценции в пределах ограниченного диапазона. В обозначении каждого HYQ-фильтра отражено название флуорохрома, для которого он был разработан, но в пределах своих диапазонов возбуждения каждая комбинация может применяться для наблюдения различных флуорохромов с соответствующими характеристиками.
Базовый список блоков флуоресцентных фильтров Nikon
В основе системы условных обозначений, применяемых компанией Nikon, лежат смешанные термины, появившиеся в начале 1990-х годов. В то время все дополнительные комбинации фильтров Nikon производились методом напыления твёрдых покрытий, но сегодня при производстве многих фильтров, применяются передовые методы мягкого покрытия. И хотя мягкие покрытия более чувствительны к влажности и нагреву и требуют более аккуратного (по сравнению с твёрдыми покрытиями) обращения, они демонстрируют более высокие значения оптической плотности и обеспечивают бо?льшую лёгкость в тонкой настройке специфичных полос пропускания. Понимание условных обозначений комбинаций фильтров Nikon позволяет быстро подбирать необходимые фильтры для специфичных флуророфоров.
Первая буква в принадлежащей компании Nikon системе буквенно-цифровых обозначений указывает на участок спектра возбуждения (например, UV, V, B, и G являются сокращениями от английских слов «ultraviolet» — ультрафиолетовый, «violet» — фиолетовый, «blue» — синий, и «green» — зелёный, соответственно). Число, следующее за кодировкой спектра возбуждения, обозначает ширину полосы пропускания фильтра возбуждения: 1 соответствует узкополосному возбуждению, 2 — среднеполосному, и 3 — широкополосному возбуждению. И, наконец, одна или несколько букв, следующих за числом, соответствующим ширине полосы возбуждения, обозначают характеристики запирающего фильтра. Буква A указывает на стандартный широкополосный запирающий фильтр с самой низкой длиной волны отсечки, B обозначает широкополосный эмиссионный фильтр, имеющий более высокую волну отсечки. Обозначение E (от английского «enhanced» — усиленный) в полосных эмиссионных фильтрах указывает на улучшенные характеристики в смысле сокращения интерференционного взаимодействия разделяемых сигналов. Обозначение E/C указывает на комбинацию мягких интерференционных покрытий, разработанных специально для работы с такими специфическими красителями, как DAPI, FITC, TRITC и техасский красный.









.png)