Подготовка образца и получение изображения
Процедуры подготовки образца и получения его изображения в конфокальной микроскопии во многом основаны на тех методах, которые были отработаны в течение многих лет в традиционной широкопольной микроскопии. Лучший подход при разработке новых процедур в конфокальной микроскопии — это взять за основу уже проверенную в традиционной микроскопии процедуру и изменять ее, по мере необходимости.
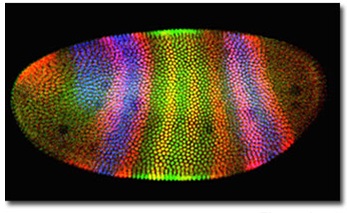
Рис. 1. Объединённое трёхканальное изображение
Независимо от используемых процедур подготовки образца, основным преимуществом конфокального микроскопа является гибкость представления изображений и всестороннего программного анализа набора одновременно снятых изображений. Подробнее об этом говорится ниже, но один элегантный пример возможностей представления изображения приведен на рисунке 1, где изображен окрашенный тремя метками эмбрион дрозофилы в стадии бластулы. Образец был иммунофлуоресцентно окрашен антителами к трем различным белкам. После получения конфокальной системой по красному, зеленому и синему каналу трех соответствующих изображений, они могли быть получены снова, но уже по другим каналам. Оценив полученные после слияния трех изображений снимки, мы выбрали лучший по соотношению цвет-канал, который нагляднее всего демонстрировал распределение различных протеиновых доменов. На рисунке 1 представлено изображение, объединенное по трем каналам (объединены красный, зеленый и синий каналы).
В большинстве методов, оказавшихся успешными в подготовке образцов для традиционного широкопольного микроскопа, особенное внимание уделялось сокращению внефокусной флуоресценции, которая приводит к засветкам изображения, что значительно понижает четкость и разрешение интересующих деталей. Благодаря технологии оптических срезов в конфокальном методе, конфокальный микроскоп субдискретизирует флуоресценцию в толстых образцах по сравнению с традиционным эпифлуоресцентным микроскопом. В результате, при конфокальном анализе может увеличиться время окрашивания некоторых образцов или потребоваться большая концентрация красителя, которые при последующем исследовании на обычном микроскопе, могут показаться как чрезмерно окрашенные.
Хотя освещение в стандартной лазерной сканирующей конфокальной системе чрезвычайно яркое, среднее значение освещенности заданной точки довольно умеренное, благодаря тому, что в одну секунду сканируется много точек. При обычной скорости сканирования одной точки за 1,6 микросекунды действительная освещенность заданной точки, в общем, меньше, чем в традиционном широкопольном эпи-флуоресцентном микроскопе. Обычно рекомендуется использовать наименьшую мощность лазера, необходимую для получения изображения, чтобы защитить флуорофор. Хотя многие процедуры включают антиобесцвечивающее вещество для предотвращения выцветания флуоресцентных образцов, во многих современных конфокальных приборах такие добавки могут и не требоваться.
Главным преимуществом (и приложением) конфокального микроскопа является возможность получать более качественные изображения толстых образцов, хотя успех иногда может ограничиваться свойствами самого образца. К образцам предъявляются минимальные физические требования: он должен уместиться на предметном столике микроскопа, а его область наблюдения должна находиться в пределах рабочего расстояния объектива. К примеру, объектив с увеличением 60x, имеющий числовую апертуру 1.4, может иметь рабочее расстояние 170 микрон, в то время как, объектив с увеличением 20x (числовая апертура 0.75) может иметь относительно большое рабочее расстояние 660 микрон, что позволяет проводить исследования более ограниченных областей без физического вмешательства в образец.
Исследуемые образцы, имеющие трехмерную структуру, должны помещаться под конфокальный микроскоп таким образом, чтобы при наблюдении эта структура сохранялась. Обычно между предметным и покровным стеклом помещается некая прокладка, например рыболовная леска или кусочек покровного стекла, для предотвращения деформации образца. При наблюдении живых образцов, они обычно помещаются в камеру, в которой поддерживаются необходимые для их жизни условия и которая, также, не перекрывает доступ объектива к областям визуализации.
Табл. 1. Параметры объективов и толщина оптического среза
|
Объектив
|
Точечная диафрагма
|
|
Увеличение
|
ЧА
|
Увеличение
|
ЧА
|
|
60x
|
1.40
|
60x
|
1.40
|
|
40x
|
1.30
|
40x
|
1.30
|
|
40x
|
0.55
|
40x
|
0.55
|
|
25x
|
0.80
|
25x
|
0.80
|
|
4x
|
0.20
|
4x
|
0.20
|
Глубина проникновения в образец лазерного луча и, следовательно, возможность наблюдения и создания изображений структуры образца сильно зависят от его свойств, влияющих на прохождение света, таких как прозрачность и мутность. Несвязанный и неокрашенный эпителий роговицы глаза, к примеру, относительно прозрачен, и лазерный луч проникает в него на глубину около 200 микрон. А несвязанная кожа, напротив, относительно непрозрачна и рассеивает большее количество света, тем самым ограничивая глубину проникновения лазера до 10 микрон. Многие процедуры связывания включают использование чистящих веществ для увеличения прозрачности ткани.
Если необходимая глубина проникновения лазера не может быть достигнута на целом образце, тотальный образец рассекается микротомом на толстые сегменты. Связанную ткань рассекают обычным способом, но для рассечения и успешного наблюдения таких тканей, как живой мозг, используется вибратом. Чтобы глубже проникнуть в гистологический срез, можно снять образец с предметного столика, перевернуть его и поместить обратно, но это не всегда приводит к успеху. Изображения более глубоких частей образца могут быть получены с помощью красителей, возбуждаемых на более длинной волне (как, например, цианин 5), в противоположность коротковолновым красителям. Использование длинноволнового освещения, тем не менее, немного понижает максимальное разрешение, в сравнении с изображениями, полученными при использовании коротковолнового облучения. По тем же причинам, методами многофотонной визуализации можно получать изображения более глубоких уровней образца (благодаря использованию красного света для возбуждения).
Объектив
Для конфокального микроскопа выбор объектива чрезвычайно важен, поскольку собирательная способность линзы, выражаемая числовой апертурой, является определяющей как для разрешения, так и для толщины оптического среза. При постоянных значениях остальных переменных, оптический срез тем тоньше, чем выше числовая апертура. В качестве примера возьмем микроскоп, в котором при использовании объектива с увеличением 60x (числовая апертура 1.4) и диаметром точечной диафрагмы выставленным на 1 мм, толщина оптического среза составляет примерно 0,4 микрометра, а при использовании 16х объектива (числовая апертура 0,5), при том же 1-миллиметровом значении точечной диафрагмы — толщина оптического среза составит порядка 1,8 миллиметра. Увеличение диаметра точечного отверстия приводит к увеличению толщины оптического среза. В таблице 1 приводятся значения толщины оптического среза (в микрометрах) для разных объективов при двух диаметрах точечной диафрагмы для одной и той же модели ЛСКМ. Вертикальное разрешение изображений всегда хуже горизонтального. Например, для объектива с увеличением 60x, числовой апертурой 1.4, горизонтальное разрешение составляет примерно 0.2 микрометра, а вертикальное — около 0.5. Плоскостность поля и хроматическая аберрация — дополнительные характеристики, которые необходимо учитывать при выборе объектива. Корректировка хроматических аберраций особенно важна при визуализации образцов, помеченных многими метками на разных длинах волн.
Объективы с наибольшим увеличением и наибольшей числовой апертурой обычно имеют наибольшее разрешение. Но они же и самые дорогие, поэтому компромисс обычно делается между областью сканирования образца и максимальным разрешением, которое может быть достигнуто для этой области. Например, при наблюдении имагинальных дисков и эмбрионов насекомых, объектива с увеличением 4x может быть достаточно для локализации образца на предметном стекле, объектива с увеличением 16x (числовой апертурой 0.5) — для визуализации целых эмбрионов, а объектива с увеличением 40x (числовой апертурой 1.2) или 60x (числовой апертурой 1.4) — для наблюдения ядер отдельных клеток эмбрионов и имагинальных дисков. При наблюдении образцов большего размера, таких как имагинальные диски бабочки, использование 4x объектива достаточно для наблюдения дисков всего крыла, а 40x или 60x объективов- для наблюдения отдельных клеток. На рисунке 2(a) представлен общий вид целого имагинального диска крыла бабочки на пятой возрастной стадии, полученный объективом с увеличением 4x, а на рисунке 2(b) — деталь ядра, полученная объективом с увеличением 16x. Добиться высокого разрешения и, одновременно, большого поля зрения можно, получив много снимков смежных областей и произведя их фотомонтаж цифровыми методами. Некоторые микроскопы имеют автоматизированные x-y координатные столики, которые могут быть настроены таким образом, чтобы, двигаясь вокруг образца, получать множество снимков, дальнейший монтаж которых дает изображения больших участков.
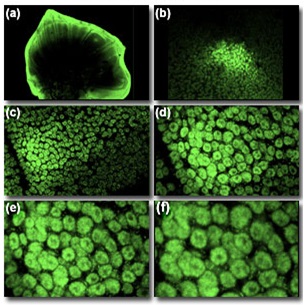
Рис. 2.Изменение масштаба изображения (трансфокация)
Но более ценной характеристикой большинства ЛСКМ является их способность изменять масштаб изображения, без смены объектива и без потери резкости изображения. Это достигается за счет простого уменьшения области образца, сканируемой лазером, управления сканирующими зеркалами, при сохранении неизменного размера отображаемого изображения или объема памяти изображения. Таким образом, возможна установка нескольких значений увеличения без смены объектива, без повреждения образца и без потери эталонных точек сравнения в поле зрения. Тем не менее, по возможности, для увеличения разрешения лучше использовать объектив с большей числовой апертурой, чем увеличивать масштаб изображения, полученного более слабым объективом. Возможность увеличения масштаба изображения при неизменном объективе (40x) показана на рисунках 2(c-f). На картинке (с) показана дополнительная деталь ядра, снятая объективом 40x (в сравнении со снимком (b), полученным с помощью объектива с увеличением16x). Ряд снимков (d) — (f) есть последовательное увеличение масштаба изображения, снятого тем же объективом 40x, при уменьшении размера сканируемой области образца.
В некоторых конфокальных установках стоит регулируемая точечная диафрагма, которая ограничивает количество внефокусного света, попадающего на приемник излучения. Увеличение открытия диафрагмы позволяет получить более толстый оптический срез, но уменьшает разрешение; хотя это часто бывает необходимо для того, чтобы охватить больше деталей образца или увеличить световой поток, попадающий на приемник. Закрывая точеную диафрагму (уменьшая диаметр), мы уменьшаем толщину оптического среза и яркость. Разрешение возрастает, пока значение диаметра не достигнет определенного минимума, за которым оно уже не меняется, а яркость продолжает падать. Диаметр точечной диафрагмы, при котором наступает это условие, различен для каждого объектива.
Зонды и красители для конфокальной микроскопии
Развитие конфокальной аппаратуры влияло и само зависит от синтеза новейших флуоресцентных зондов, облегчающих иммунофлуоресцентную локализацию. Спектры возбуждения и испускания появляющихся флуорохромов приближаются к длинам волн, на которых работают лазеры большинства коммерческих ЛСКМ. Постоянно разрабатываются улучшенные красители, которые могут соединяться с антителами, представляющими интерес. Как пример, можно привести цианины — группу красителей, которая была разработана в качестве альтернативы общепринятым красителям. В этой группе, цианин 3 является более яркой альтернативой родамину, а цианин 5 становится все более востребован в методиках тройного окрашивания.
Флуоресцентная гибридизация in-situ (FISH) имеет преимущества в разрешении и чувствительности обнаружения зондов, которые лишь усиливаются при использовании в ЛСКМ. Этот метод оказался весьма ценным при визуализации распределения последовательностей флуоресцентно окрашенных ДНК и РНК в клетках. Кроме того, сейчас используются более яркие флуоресцентные зонды при визуализации на ЛСКМ целых ДНК как в ядрах, так и в отдельных хромосомах.
При соблюдении относительно простых правил, многие флуоресцентные красители могут использоваться для специального окрашивания определенных клеточных органелл и структур. Среди множества имеющихся в наличии зондов есть те, которые предназначены для окрашивания ядра, аппарата Гольджи, эндоплазматической сети, митохондрий, а также такие красители, как флуоресцентно окрашенный фаллоидин, свечение которого указывает на наличие полимеризированного актина в клетках. Использование таких красителей при исследовании мультиокрашенных образцов, помогает локализовать представляющие интерес антигены, занимающие особые области в клетке. На рисунке 3 представлено изображение, полученное с использованием комбинации фаллоидина и красителя ядра (ToPro) с подходящим антигеном в методике тройного окрашивания, примененной к тотальным препаратам имагинальных дисков крыла куколки бабочки. Как показано на рисунке 3 (a), фаллоидин может использоваться для выделения контуров клетки в развивающихся тканях (яркие флуоресцентные кольца представляют собой периферическую сеть актинов). Рисунок 3 (b) иллюстрирует особую специфичность красителя ядра, поскольку отмечен только этот компонент клетки. В эту методику окрашивания определенных клеточных отделов, можно включить антитела протеинов с известным распределением или функцией в клетке (такие как антитубулин), которые могут быть успешно использованы при исследовании мультиокрашенных образцов.
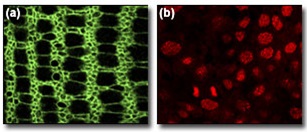
Рис. 3. Выделение клеточных характеристик
При наблюдении живых клеток очень важно представлять себе последствия добавления флуорохромов в систему. Эти зонды могут оказаться токсичными для живых клеток, особенно при облучении лазером. Токсичность зондов может быть уменьшена в некоторых процедурах приготовления образцов путем добавления аскорбиновой кислоты в клеточную среду. Жизнеспособность клетки во время наблюдения может зависеть от того, какой именно компонент отмечен красителем. Например, красители ядра клетки оказывают более вредное воздействие, чем красители цитоплазмы. Есть красители, оказывающие различное воздействие на живые и мертвые клетки (среди них акридиновый оранжевый), и это может быть использовано при оценке жизнеспособности клетки во время наблюдения. Такой анализ основан на предположении, что мембраны мертвых клеток проницаемы для многих веществ, таких как красители, которые не могут проникнуть в них, когда они живые.
Fluo-3 и rhod-2 — это примеры красителей, синтезированных для изменения флуоресцентных показателей в присутствии определенных ионов, например кальция. Для визуализации экспрессии генов были разработаны новые красители, как, например, зеленый флуоресцирующий белок медузы (GFP), с помощью которого можно наблюдать экспрессию генов и локализацию белка in vivo. GFP позволяет следить за экспрессией генов в клетках различного типа, включая ооциты живой Drosophila (дрозофилы), клетках млекопитающих и растений (на 488нм линии возбуждения лазера ЛСКМ). Мутанты GFP со спектральными вариациями могут быть использованы в экспериментах с окрашиванием многими метками; их применение также имеет смысл, когда необходимо избежать автофлуоресценции в живых тканях.
Автофлуоресценция
Автофлуоресценция тканей возникает естественным образом в клетках многих типов и может быть основным источником фоновых помех в процессе наблюдения. Например, хлорофилл в дрожжах и клетках растений флуоресцирует в красной части спектра. Определенные реагенты, например фиксатор глутаральдегид, являются источниками автофлуоресценции, которая может быть уменьшена при обработке образцов борогидридом. Автофлуоресценции иногда можно избежать, используя флуорофоры, которые возбуждаются на длине волны вне диапазона естественной автофлуоресценции. Часто выбирается цианин 5, поскольку его длина волны возбуждения больше коротковолновой автофлуоресценции.
Хотя в большинстве случаев автофлуоресценция тканей считается проблемой, она может быть использована для визуализации общей морфологии клетки, как часть методики исследования мультиокрашенных образцов. Вклад автофлуоресценции в общее флуоресцентное свечение может быть оценен при наблюдении неокрашенного образца на разных длинах волн, с учетом мощности лазера и настроек ФЭУ в режимах отсутствия и приема сигнала. Автофлуоресценцию можно высветить (выжечь), либо кратковременно облучив образец лазером на высокой мощности, либо залив его светом ртутной лампы. Более сложным подходом к контролю автофлуоресценции является визуализация с разрешением во времени или цифровые методы обработки изображения, как, например, вычитание изображений.
Сбор и получение изображений
Начинающие пользователи могут приобрести опыт работы с конфокальными микроскопами несколькими способами. Руководство, поставляемое производителем в комплекте с микроскопом, содержит описание нескольких простых процедур, необходимых для начала работы. В большинстве организаций, где установлено многопользовательское оборудование, ответственное лицо может провести несколько ознакомительных демонстраций; руководитель отдела может организовать несколько тренировочных занятий и тестов перед тем, как допускать пользователя к работе с аппаратурой. Особенное внимание должно быть уделено внутренним инструкциям по использованию оборудования. Можно также пройти обучение на тренировочных курсах, организованных поставщиком оборудования, и получить информацию на семинарах по микроскопии и из множества публикаций.
Перед тем как начать работу с экспериментальными образцами, важно ознакомиться с основными функциями системы формирования и визуализации изображения. Новичку лучше начинать с создания пробных изображений относительно простых образцов, чем сразу со сложного эксперимента. В качестве образца для тренировочных наблюдений можно выбрать бумагу, пропитанную одним или более флуоресцентным красителем, или образец с флуоресцентными гранулами. Оба типа этих образцов ярко флуоресцируют и относительно хорошо просматриваются конфокальными системами. Другим превосходным образцом для обучения является смесь пыльцевых зерен, автофлуоресцирующих на многих длинах волн. Она может быть легко приготовлена из пыльцы, собранной с садовых растений, или приобретена у поставщиков биологических препаратов. Изображения пыльцевых зерен, представленные на Рис. 4 были получены одновременно при одинаковых настройках ФЭУ и при одном и том же диаметре точечной диафрагмы, но при этом четко выявляют наличие пыльцы трех типов, флуоресцирующей каждая на своей длине волны. Эти образцы хороши для проведения тестов не только потому, что они имеют интересную поверхность, но и потому, что их свойства относительно хорошо сохраняются при облучении лазерным лучом. Для пробных экспериментов с живыми тканями, хорошо подходят препараты эпителия лука или водного растения Elodea, которые можно либо окрасить красителем DiOC6, либо наблюдать их автофлуоресценцию.
Перед началом работы с получением изображений, конфокальный микроскоп необходимо настроить для получения наилучших результатов. Это требует оптимальной юстировки прибора, особенно при работе с микроскопами более старых моделей. Для каждого прибора существуют свои процедуры юстировки, которые лучше всего проводятся лицом, ответственным за его техническое обслуживание. Юстировка ни в коем случае не должна выполняться без специального обучения и разрешения владельца микроскопа. Неправильно выполненная юстировка прибора может привести к полной потере луча и в некоторых случаях к необходимости вызова специалиста для восстановления работы микроскопа.
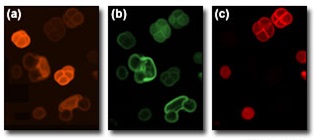
Рис. 4. Автофлуоресценция пыльцы
Конфокальные системы основаны на конструкции традиционного оптического микроскопа, поэтому основополагающие процедуры и правила оптической микроскопии должны соблюдаться неукоснительно. Чрезвычайно важно, чтобы все стеклянные поверхности на пути луча были чистыми, поскольку пыль, масло и грязь на предметном и покровном стекле, на объективе — это первая причина неудачных снимков. Показатель преломления среды между объективом и образцом должен соответствовать выбранному объективу. Например, используемое иммерсионное масло должно соответствовать числовой апертуре объектива, а образец должен быть помещен в пределах рабочего расстояния объектива. Толщина покровного стекла должна соотноситься с используемыми объективами, особенно при работе с объективами с большой светосилой, когда необходимо использовать покровное стекло № 1 или № 1,5 вместо № 2. Покровное стекло должно плотно прилегать к предметному стеклу с помощью соответствующей среды, и должно лежать строго горизонтально. Для связанных образцов можно использовать, например, лак для ногтей, при этом перед началом наблюдений необходимо убедиться, что лак полностью высох. Для живых образцов можно использовать смесь вазелина, воска и ланолина или какой-нибудь другой нетоксичный герметик.
Строгое соблюдение процедур по подготовке предметного столика может сэкономить много времени и усилий в дальнейшем.
Во время подготовки к конфокальным исследованиям, участок, представляющий интерес локализуется методами светлопольной микроскопии или традиционной эпифлуоресцентной микроскопии. Конечно, это предпочтительно делать конфокальной системой, но для начинающего пользователя будет весьма трудно найти нужную фокальную плоскость, находясь только в режиме конфокального наблюдения. Если в конфокальном микроскопе не предусмотрены режимы традиционного наблюдения, определить положение интересующих структур можно с помощью отдельного флуоресцентного микроскопа, отметив их положение алмазным маркером, простым маркером, или записав их координаты. Перед наблюдением какого-нибудь редкого явления, особенно полезно иметь возможность предварительного просмотра образцов через конфокальный микроскоп, например, если вы собираетесь наблюдать экспрессию гена на определенной стадии развития в образце, содержащем, возможно, сотни эмбрионов на разных стадиях развития. В этом случае можно сэкономить много времени, которое бы пришлось потратить на сканирование большого числа образцов в конфокальном режиме. Обычно, конфокальные приборы имеют режим быстрого сканирования с низким разрешением, что делает предварительное сканирование более эффективным. Тем не менее, наилучшим подходом при наблюдении редкого явления будет сканирование образцов в традиционном режиме и немедленное переключение в конфокальный режим (на том же самом микроскопе) для получения изображений.
Успешная конфокальная визуализация зависит от умения найти оптимальное соотношение между числовой апертурой объектива, диаметром точечной диафрагмы, яркостью образца и минимальной мощностью лазера, необходимой для получения наилучшего изображения. Начинающему пользователю следует поэкспериментировать с пробными образцами, меняя эти параметры, пробуя объективы с различным увеличением и числовой апертурой, чтобы почувствовать возможности микроскопа перед тем как приступить к наблюдению экспериментальных образцов. Следует сравнить изображения, полученные с использованием трансфокатора, с теми, которые были сняты с объективами большей числовой апертуры. Это позволит определить наиболее подходящие объективы и методы. На рисунке 5 показаны два объектива, выбранные из большого числа используемых в конфокальной микроскопии: план-апохроматическиймасляно-иммерсионный объектив с увеличением 60x и план-флюоритовый объектив с увеличением 20x. Последний имеет регулировочное кольцо, которое можно заполнять маслом, глицерином или водой в качестве иммерсионной среды.
Параметры микроскопа, относящиеся ко всему образцу, должны настраиваться вне области, представляющей интерес, чтобы избежать фотообесцвечивания в ней флуоресцентных красителей. Обычно к этим параметрам относятся усиление и темновой ток фотоумножителя в сочетании с диаметром точечной диафрагмы, при правильной настройке которых достигается баланс между приемлемой разрешающей способностью и соответствующим контрастом, а также минимально возможная мощность лазера для уменьшения фотообесцвечивания. Многие приборы снабжены кодовой таблицей цветов для введения в настройки правильного динамического диапазона для изображения. Эти таблицы составлены так, что самые темные пиксели, имеющие яркость близкую к нулю, произвольно изображаются зеленым (например), а наиболее яркие пиксели, со значением близким к 255 в 8-битной системе, изображаются красным. Параметры микроскопа, такие как усиление и темновой ток или диаметр точечной диафрагмы, настраиваются таким образом, чтобы в изображении было немного зеленых и красных пикселей, обеспечивая тем самым использование всего динамического диапазона с небольшой отсечкой по его краям. Хотя эти настройки и можно провести на глаз, использование псевдоцвета на краях динамического диапазона системы визуализации делает их менее субъективными. В некоторых случаях изображения следует получать, используя не полный динамический диапазон системы, например, когда необходимо работать на мощности лазера меньше оптимальной, или когда образец имеет неравномерную флуоресценцию, при которой более яркие участки мешают наблюдению тусклых, но представляющих интерес участков изображения.

Рис. 5. Объективы для лазерной сканирующей конфокальной микроскопии
Во время сканирования образца обычно применяется программа усреднения изображения для снижения случайного шума от приемников излучения системы и для усиления неслучайных характеристик изображения. Алгоритм коррекции изображения может быть применен после сбора изображений, с целью увеличения их масштаба до полного динамического диапазона монитора. В случае, когда необходимо провести измерения флуоресцентного свечения, ни одну из этих программ не следует применять, пока контрольный снимок не будет помещен в один блок данных с экспериментальными снимками. При использовании любой программы обработки изображения не будет лишним сохранить, в дополнение к обработанным, и необработанные изображения.
Обычно, изображения сохраняются на жестком диске компьютера конфокальной системы, а позже резервные копии сохраняются на другом устройстве хранения информации. В течение сеанса наблюдений, как правило, рекомендуется создавать как можно больше снимков, а от ненужных избавляться во время последующего просмотра. Многие изображения, показавшиеся ненужными сначала, могут стать весьма ценными позже, при дальнейшем изучении (особенно совместно с коллегами). Может показаться расточительным сохранять избыточные изображения, но стоит учесть, что приготовить еще один образец гораздо труднее, и еще труднее воспроизвести те же самые условия эксперимента или хотя бы точно повторить процедуру подготовки образца.
Система информативных пометок файлов изображений должна быть разработана до начала наблюдений. Различные пометки и замечания к изображению, возникающие в процессе наблюдения, необходимо прикреплять к файлу изображения, если, конечно, система предоставляет такую возможность. В том, что информация, относящаяся к изображению доступна и после его сохранения, необходимо убедиться во время тестирования, имея в виду, что при отправке снимка в программы редактирования изображений на других компьютерах, такие как NIH Image или Adobe Photoshop, тексты и любая другая информация могут быть потеряны. Подробный и хорошо организованный файл в ноутбуке или другом переносном ПК может оказаться в этом случае предпочтительнее других средств записи деталей сеанса наблюдения. Он должен содержать названия снимков, комментарии к ним, данные об используемом объективе и применяемом масштабе увеличения, необходимые для последующего анализа снимка. Большинства конфокальных систем не производят автоматической записи об используемом объективе, а эта информация важна для расчета ширины поля и последующего масштабирования, обязательных для дальнейших публикаций. Во многих современных системах используются базы данных изображений, упорядочивающие снимки по имени и расположению, и часто представляющие закрытые снимки в виде миниатюрных изображений. Необходимо внимательно отнестись к ограничениям, накладываемым системой на названия файлов, таким как количество допускаемых в имени файла символов, или на сами символы (пробел, точка), которые могли бы быть неправильно интерпретированы программой.
Устранение неисправностей
В любой экспериментальной дисциплине отработанные процедуры, приводящие к хорошим результатам, иногда дают сбой по необъяснимым причинам. Когда это случается в экспериментах по конфокальной визуализации, первое желание — приписать сбой аппаратуре, но прежде, чем приступить к устранению неисправностей, необходимо быть абсолютно уверенным, что причина не в образце. Первое, что лучше всего сделать, это посмотреть образец на традиционном эпифлуоресцентном микроскопе. Если флуоресценция наблюдается визуально, то на правильно работающей конфокальной системе этот сигнал должен быть очень ярким. Убедившись, что образец флуоресцирует, конфокальную систему необходимо проверить на тестовом образце с заданными характеристиками (а не на экспериментальном). Для сравнения в конфокальной системе должен храниться файл контрольного снимка тестового образца, доступный всем пользователям микроскопа; он должен содержать параметры получения изображения, такие как мощность лазера, диаметр точечной диафрагмы, масштаб увеличения, характеристики объектива, усиление и темновой ток приемника излучения.
Если предпринятые шаги не привели к устранению неполадки, лучше обратиться к эксперту, который, возможно, уже сталкивался с этой проблемой. Если пользователь в чем-то не уверен, лучше обратиться за помощью, чем предпринимать какие-либо меры самому. Все поставщики конфокальных микроскопов имеют телефонные линии помощи и вэб-сайты, куда всегда можно обратиться.
Проблемы, возникающие при подготовке образцов, обычно возникают из-за ухудшения реагентов, которые необходимо проверять серией диагностических тестов. Тем, кто проводит эксперименты, лучше готовить свои реагенты или, в крайнем случае, брать их у коллег, которым они доверяют. Антитела из низкотемпературных хранилищ должны распределяться маленькими партиями, после чего храниться в холодильнике. Использовать повторно их следует только в случае крайней необходимости. Конечно, с редкими или дорогими реагентами этого не избежать, но, обычно, приобрести реагент не представляет проблемы.
В экспериментах с мультиокрашенными образцами, иногда наблюдается проступание из одного канала в другой, что может являться следствием либо свойств самого образца, либо проблем, связанных с микроскопом. Описание причин проступания и возможных методов его устранения можно найти в опубликованных обзорах. Хорошая проверка самого микроскопа включает проведение исследования контрольного образца, окрашенного несколькими или одиночным красителями, с известными свойствами проступания. Снимки контрольного образца должны храниться со всеми необходимыми записями о настройках микроскопа для того, чтобы в случае возникновения проблемы, контрольный образец можно было бы «переснять» в тех же самых условиях.
При возникновении неисправностей, необходимо также визуально проверить цвет лазерного освещения и анодное напряжение лазера. Если, например, луч криптонового/аргонового лазера оказывается синим вместо белого, при сканировании мультиокрашенных образцов, это говорит о слабости красной линии. В этом случае анодное напряжение, скорее всего, слишком высокое, и, обычно, оно уменьшается до приемлемого уровня настройкой зеркал лазера. Такие настройки должны проводиться лицом, ответственным за эксплуатацию конфокального микроскопа, или под его наблюдением. Если напряжение не удается вернуть в нужный диапазон, может потребоваться замена лазера.
Другой проблемой может оказаться ухудшение свойств антител, либо необходимость их повторной или какой-либо другой очистки. В образцах, приготовленных заранее, может возрасти фоновая флуоресценция и проступание, вызванные отделением флуорохрома от вторичного антитела и его проникновением в окружающую ткань. Конечно, если возможно, лучше наблюдать свежеприготовленные образцы. Иногда проблему помогает снять изменение концентрации и/или распределения флуорохромов. Например, флуоресцеин может проступать в канал родамина и усиливать его. Причина этого явления в том, что спектр возбуждения флуоресцеина имеет хвост, частично перекрывающий спектр родамина, что приводит к возбуждению первого в частотном диапазоне родамина. В этом случае можно сократить концентрацию вторичных антител.
Обработка изображения и документирование
Снимки, полученные конфокальным микроскопом, обычно хранятся в оцифрованном виде в формате, позволяющем легко работать с ними с помощью собственных программ обработки изображений, поставляемых вместе с конфокальной системой. Возможности представления и отображения конфокальных снимков явились одним из самых существенных усовершенствований современных ЛСКМ. Это действительно очень важно, так как успехи конфокальной микроскопии в наблюдении имеют небольшую ценность, если нет возможности эффективно отобразить полученные изображения или воспроизвести их документальную копию.
Еще 5 лет назад в большинстве лабораторий находились традиционные фотолаборатории (так называемые темные комнаты), где проявлялись пленки и бумага для получения окончательных документальных копий снимков. Особенно трудно было получать цветные снимки, поскольку они обычно печатались в независимых типографиях, где имели смутное представление о том, что значит надлежащий цветовой баланс микроснимка; и цена печати была высока. Сейчас, чтобы получить документальные копии снимков, файлы с изображениями достаточно отправить на слайд-принтер, цветной лазерный принтер или принтер с термической возгонкой красителя, где под непосредственным контролем автора этих снимков они будут напечатаны с качеством, пригодным для публикации. Изображения для фотографий или слайдов могут быть взяты непосредственно с экрана монитора, а видео может быть опубликовано в Интернете.
Сейчас большинство журналов может принимать для публикации изображения в оцифрованном виде, и это привело к кардинальному улучшению качества публикуемых снимков. Теперь качество изображений, получаемых конфокальной системой визуализации, может быть воспроизведено в публикуемых статьях с большей достоверностью. Иногда статьи журналов доступны и на компакт-дисках. Это означает, что читатели получают доступ к изображениям точно в том виде, в котором они были получены исследователями, работающими на конфокальных системах. Не удивительно, что технологические успехи в получении снимка, его демонстрации и публикации особенно проявились в случае цветных изображений; теперь они могут воспроизводиться в журналах с оригинальным разрешением и балансом цвета и, теоретически, гораздо дешевле для автора.
Критические аспекты конфокальной микроскопии
Всем известно, что флуоресцентные микроснимки отображают положение окрашенных молекул в тканях, не так ли? Бывает, что и нет. На самом деле, производя измерения на лазерном сканирующем конфокальном микроскопе во флуоресцентном режиме, мы можем быть уверены лишь в том, что определенное количество фотонов было зарегистрировано за определенное время. Мы можем надеяться, что это точное измерение одного или двух интересных параметров — локальной концентрации определяемого вещества или какого-нибудь иона. В действительности на числовые значения, хранящиеся в памяти компьютера, в любой момент влияет множество факторов.
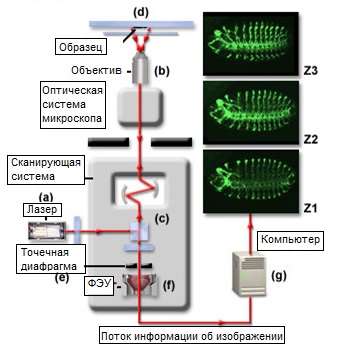
Рис. 1. Создание 3-D изображений и визуализация в конфокальной микроскопии
На рисунке 1 показана блок-схема лазерного сканирующего конфокального микроскопа, содержащая в себе «39» факторов, упомянутых в тексте. В основу изображенной системы положен инвертированный оптический микроскоп, настроенный на визуализацию живых клеток. Отдельные компоненты, ссылки на которые есть в нижеследующем тексте, отмечены буквами (a) — (g). На рисунке также изображены три оптических среза, полученные на разных уровнях по оси z при наблюдении эмбриона дрозофилы, меченного антителами и обозначенные Z1, Z2 и Z3.
За время существования курсов по трехмерной микроскопии живых клеток, проводимых каждый год в июне в университете Британской Колумбии, студенты — слушатели курсов — составляли список этих внешних факторов. В первый год список вырос до 39 пунктов, поэтому его название было заимствовано у фильма Альфреда Хичкока. С тех пор список продолжает расти! (Подробную информацию о курсах можно найти в Интернете на Доске объявлений курсов по 3-D микроскопии).
Хотя в этой статье невозможно описать каждый термин, в нее включены некоторые краткие и полезные объяснения. Термины выделены жирным шрифтом, и многие связаны между собой. Надо иметь в виду, что многие из этих переменных обычно понимаются в смысле их влияния на пространственное разрешение. Они приведены здесь, потому что под уменьшенным разрешением понимается «попадание такого же числа фотонов возбуждения на большую площадь». Это понижает интенсивность возбуждения — количество фотонов, испускаемых данной молекулой — и долю зарегистрированных фотонов. Обычно забывается, что нормальный уровень сигналов во флуоресцентной конфокальной микроскопии соответствует всего лишь 10–20 фотонам на пиксель в самых ярких областях. В этих условиях флуктуационный шум накладывает на пространственное разрешение более строгое ограничение, чем определяемое уравнением Аббе:
dmin = λ0 / (NAobj + NAcond)
В этом уравнении d(min) является минимальным различимым расстоянием в периодической решетке, что в нашем случае является поперечным расстоянием в пространстве образца; λ(0) длина волны света в вакууме; NA(obj) и NA(cond) числовые апертуры объектива и линзы конденсора, соответственно. Уравнение устанавливает связь числовой апертуры объектива и линзы конденсора с разрешением изображения на данной длине волны.
Лазерный модуль (рисунок 1(a)) — это источник освещения, и, в целом, измеряемая флуоресценция пропорциональна мощности лазера. Хотя общая выходная мощность лазера обычно регулируется, этого нельзя сказать о мощности на каждой длине волны в случае многоволнового лазера, более того, она может значительно меняться во времени. Оптические характеристики зависят от длины волны, которая через спектр поглощения красителя определяет количество света флуоресценции.
Нестабильность выходной мощности — это, как правило, шум; обычно, она менее 1 процента, но может значительно возрасти по мере износа лазера. Поскольку пыль, разюстировка и механическая нестабильность могут вызывать случайные изменения в пределах 10–30 процентов, эффективность оптической связи с волоконным световодом (если используется) является критической.
Отражательная способность и соосность (юстировка) зеркал лазера могут быть причиной долговременного дрейфа выходного сигнала лазера. Поскольку положение источника лазерного излучения определяется зеркалами лазера, погрешность наведения луча/юстировки являются важными характеристиками. Нестабильность здесь проявится в виде изменения яркости, поскольку изменение положения источника излучения повлияет на эффективность оптики, направляющей лазерный свет в одномодовое оптоволокно, используемое в большинстве приборов.
От числовой апертуры объектива (рисунок 1(b)) зависит, какая доля света, испускаемого источником, будет собрана. Это относится и к свету, генерируемому лазерным излучателем. Увеличение объектива находится в обратной зависимости к диаметру входного зрачка линзы объектива. Объектив работает нормально, только если весь входной зрачок заполнен светом возбуждения лазера. Неполностью заполненный зрачок приводит к уменьшению пространственного разрешения и падению пиковой интенсивности, а переполнение — к потере части света из-за попадания части лазерного излучения на металлическую оправу объектива, и, соответственно, потерю части излучения, что также уменьшает интенсивность светового пятна.
Чистота компонентов системы имеет очень важное значение, поскольку загрязненная оптика создает расплывчатые и тусклые световые пятна. Коэффициент пропускания (часть света, падающего на объектив, которая фокусируется в точку на его другой стороне) зависит от длины воны. Будьте осторожны с использованием некоторой относительно новой, оптики с многослойными покрытиями в ИК-диапазоне. Хроматическая и сферическая аберрации увеличивают пятно света и меняются с длиной волны. К тому же, на сферическую аберрацию сильно влияет толщина покровного стекла и показатель преломления иммерсионной среды и промежуточной среды.
Дифракция является непреодолимым ограничением оптического разрешения. Она существенно размывает объекты, меньшие дифракционного предела, понижая при этом их яркость.
Сканирующая система (рисунок 1(с)), и, особенно, управление трансфокатором (регулировка увеличения), определяют размер пикселя образца. Для выборки Найквиста пиксель должен быть, по крайней мере, в два раза меньше наименьшей детали, которую вы хотите различить в образце. Если по критерию Релея разрешение составляет 200 нанометров, то пиксели должны быть менее 100 нанометров. Субдискретизация при пикселях большего размера приведет к падению яркости мелких деталей.
Интенсивность обесцвечивания пропорциональна площади масштабирования. Что касается скорости сканирования, то чем больше время задержки на определенном пикселе, тем больший сигнал будет получен и тем меньше он будет искажен пуассоновским шумом. При высокой скорости сканирования (менее 100 наносекунд/пиксель), сигналы от красителей с постоянной затухания флуоресценции большей времени задержки, могут уменьшаться.
Размер растра — Наряду с трансфокацией (масштабированием), количество пикселей по краям вашего растра определяет размер пикселя. Большее количество пикселей (1024×1024 против 512×512) уменьшает субдискретизацию, но означает, что необходимо либо уменьшать время задержки на каждом пикселе, сокращая при этом количество полученных от него фотонов и увеличивая пуассоновский шум, либо увеличивать время сканирования, что может вызвать более сильное обесцвечивание наблюдаемого образца. Оптика и сканирующие зеркала могут вносить геометрическое искажение (дисторсию) изображения, приводящее к несоответствию формы предмета и его изображения. Большое значение имеет окружающая среда: различное оборудование, например охлаждающие вентиляторы, могут быть источниками вибрации и рассеянных электромагнитных полей. Это может вызвать неправильное отклонение зеркал, что приводит к возникновению дисторсии, которая может изменяться во времени.
Другие оптические компоненты характеризуются коэффициентом пропускания, который определяет степень отсутствия потерь на поглощение и отражение в этих компонентах, особенно в нейтральных и полосовых фильтрах, светоделителях и объективах. Отражения на поверхностях раздела воздух/стекло обычно приводят к потере сигнала, но могут проявляться как яркие пятна, не связанные со структурой образца. Коэффициент отражения зеркал может сильно зависеть от длины волны в инфракрасной и ультрафиолетовой области спектра и падает с во влажной и пыльной среде.
К выбору толщины покровного стекла (самого дешевого оптического компонента) обычно подходят наиболее небрежно. Она должна составлять 170 ± 5 микрометров. А что касается иммерсионного масла, то его коэффициент преломления должен строго соответствовать используемому объективу. Это возможно лишь в малом диапазоне температур, но оно может быть и специально смешанным. Немаловажно также положение фокальной плоскости, поскольку элемент выше или ниже нее будет казаться более тусклой по сравнению с элементом, расположенным на самой фокальной плоскости. При трехмерной визуализации, выборку Найквиста необходимо использовать и при сканировании z-плоскостей. В конце концов, простое механическое смещение предметного столика может привести к изменению изображаемой плоскости предмета со временем.
Концентрация используемого красителя, возможно, именно то, что вы стараетесь измерить. Проникновение в образец (или пространственная эксклюзия из образца) часто зависит от ионной силы и pH. Эффективное сечение поглощения — это измерение части потока фотонов возбуждения, поглощаемых молекулой красителя. Оно зависит от способа связывания пробы, pH, концентрации специфических ионов и ионной силы.
Квантовый выход характеризует вероятность того, что поглощаемая энергия фотона возбуждения, будет испущена повторно в виде флуоресцирующего фотона. Квантовый выход сильно зависит от длины волны. На него также влияют pH, концентрация специфических ионов, ионная сила и взаимодействие красителя с белком. Насыщение синглетного состояния происходит, когда лазерное излучение мощностью более одного милливатта используется с объективом высокой числовой апертуры. В этом случае интенсивность света достаточна, чтобы перевести все молекулы красителя в сечении луча в возбужденное состояние, что приводит к падению квантового выхода красителя.
Под загрузкой подразумевается количество красителя, которое вы внесли в клетку. Важными переменными являются количество молекул/антител красителя, или другого маркера белка, а также используемая процедура связывания/проникновения. Тушением (подавлением сигнала) называется поглощение флуоресцентного свечения молекулы красителя соседними с ней молекулами. Под разгрузкой подразумевается изъятие находящегося в клетке красителя или его инактивация каким-либо способом.
Скорость реакции с субстратом относится к красителям с такими флуоресцентными свойствами, благодаря которым они взаимодействуют с ионами и другими молекулами клетки. Время задержки на пикселе составляет микросекунды, и этого может быть недостаточно для достижения равновесия. Предварительным обесцвечиванием называется обесцвечивание перед проведением текущего измерения.
Компартментализацией (пространственное разделение) называется перераспределение красителя под действием внутриклеточных процессов. К взаимодействиям краситель/краситель относится не только вышеупомянутое тушение, но и резонансный перенос энергии флуоресценции (FRET). Это происходит, когда спектр испускания одного красителя перекрывается спектром поглощения второго, молекула которого находится рядом (на расстоянии нескольких нанометров). FRET может привести к испусканию света только на длине волны испускания второго красителя. Если вторая молекула не флуоресцентна, как обычно бывает, флуоресценция теряется или тушится. Влияние красителя на образец может проявляться в изменении многих параметров, включая снижение жизнеспособности образца.
Показатель преломления образца (рисунок 1(d)) и его среда для заливки определяют величину сферической аберрации. Даже при наблюдении биологических образцов в водной среде с помощью объектива с водным наполнением, соответствие далеко от совершенного, или даже близкого. Сферическая аберрация этого типа — основная причина потерь сигнала с увеличением глубины проникновения.
Важно, чтобы используемое иммерсионное масло имело соответствующий показатель преломления и дисперсию (изменение показателя преломления в зависимости от длины волны). Наличие воздушных пузырей, проявляющих себя как линзы, в иммерсионной среде не допускается. Убедиться в их отсутствии можно с помощью линзы Бертрана, используемой для выравнивания фазовых колец.
Нахождение клетки в живом состоянии может влиять на эксперимент, поскольку размер, форма и ионное окружение живой клетки отличны от мертвой. Автофлуоресценция связана с наличием эндогенных флуоресцентных соединений. Эффективность этих молекул может меняться с изменением pH, ионной концентрации и метаболического состояния. Побочная автофлуоресценция может быть связана с неправильным связыванием, особенно при использовании глутаральдегида.
Преломляющие структуры или органеллы между объективом и фокальной плоскостью, например, сферические липидные глобулы, могут перефокусировать луч в совершенно неизвестное положение. Меньшие структуры имеют меньший эффект, но любая структура, рассеивающая луч, уменьшает интенсивность фокусного пятна, а следовательно и принимаемого сигнала. Их кумулятивный эффект тоже вносит вклад в отображение клеток, показатель преломления которых гораздо выше, чем у воды.
Присутствие или отсутствие сильно окрашенных структур выше или ниже фокальной плоскости влияет на разрешение по оси z. Большие структуры, если они сильно окрашены, могут поглощать большую долю потока облучения.
Сигнал, проходящий через точечное отверстие (точечную диафрагму) (рисунок 1(e)), пропорционален квадрату диаметра точечного отверстия (или ее размера), который обычно полагается равным диаметру диска Эйри в плоскости точечного отверстия. Большое значение имеет юстировка: изображение лазера, сфокусированное на образце и рефокусированное оптической системой обратно, должно совпадать с центром точечного отверстия.
В качестве приемника излучения (рисунок 1(f)) обычно используется фотоумножитель (ФЭУ). Принимаемый сигнал прямо пропорционален квантовому выходу. Эффективный квантовый выход фотоумножителей, используемых в большинстве конфокальных микроскопов, падает от 15 процентов в синем конце спектра до порядка 4 процентов в красном. Что касается времени отклика, то большинство флуоресцентных сигналов умножаются быстро, но на другие, такие как трансмембранные токи, приемник реагирует медленно, из-за чего необходимо понижать скорость сканирования.
Напряжение ФЭУ определяет коэффициент его усиления. Возрастание напряжения на 50 вольт соответствует коэффициенту усиления 2. Необходимо иметь в виду, что регулировка темнового тока ФЭУ (или яркости) приводит к случайному усилению или уменьшению сигнала, приходящего на цифровой преобразователь. Темновой ток должен быть выставлен таким образом, чтобы уровень сигнала в самой темной части изображения был равен 5–10 единиц.
Существует много различных источников шумов, искажающих регистрируемое значение. В ФЭУ обычно присутствует шум темнового тока, но он обычно мал по сравнению с уровнем сигнала. Но это в меньшей степени верно для ФЭУ, работающих в красной спектральной обрасти, или при наблюдении слабо окрашенных образцов. Если не считать рассеянного света, который может случайно попасть в ФЭУ, основным источником шума в них остается пуассоновский или статистический шум. Он равен квадратному корню числа фотонов, зарегистрированных в данном пикселе. Это значит, что шум растет с ростом сигнала, даже если отношение сигнал-шум улучшается.
Оцифровка, обычно производимая компьютером (рисунок 1(g)), должна быть линейной. Уровень электронного сигнала, приходящего на цифровой преобразователь «8-битных» микроскопов, должен попадать в диапазон от 1 до 255. Значения от 10 до 220, учитывая наличие статистического шума, являются более безопасными. Коэффициент цифрового преобразования характеризуется соотношением между числом зарегистрированных фотонов и записываемым числом. Он зависит от напряжения ФЭУ и других характеристик усиления, но для нормальных образцов, регистрируемых на 8-битных приборах, приблизительно равен 30.
Имейте в виду: для того, чтобы аккуратно измерить один из этих параметров, остальные 38 должны сохраняться постоянными. Удачи!









.png)